Bu yazıyı okuyarak organik kimya (karbon kimyasına giriş, organik bileşikler) ünitesini hızlı tekrar edebilirsiniz. İstediğiniz konunun detaylı anlatımına ulaşabilirsiniz. Listeleme içerik akışına göre gidecektir.
[Detaylı anlatım konusu: Organik Bileşikler]
- Karbon elementi “4 tane bağ yapması ve bu bağların sayısız kombinasyonu olması sayesinde” organik kimyanın temelini oluşturan elementtir.
- Basit formül: Bileşikteki elementlerin en sade halinin görüldüğü formüle denir.
- Molekül formülü: Bileşik içindeki atomların gerçek sayılarını gösteren formüllere gerçek formül adı verilir.
- Yapısal formülü: Yapısal formülde moleküldeki atomlar arasındaki bağlanma, çizgilerle gösterilir ve atomların birbirlerine nasıl bağlandıkları hakkında bilgi verir.
- Çizgi – bağ formülleri: Organik kimyada uzun zincirli molekülleri daha kolay göstermek, yazabilmek için çizgi bağ formülü kullanılmaktadır. Çizgi bağ formülü yazarken önce Hidrojen atomları sonra karbon atomları çıkartılır. Daha sonra çizgi ile gösterilir.
[Detaylı anlatım konusu: Lewis Formülleri]
- Oktet kuralı: Atomların en dış katmanındaki elektron sayılarını 8’e tamamlamasıdır.
- Dublet kuralı: Atom numarası küçük olan (Hidrojen, lityum gibi) elementlerin tek katmanındaki elektron sayılarını 2’ye tamamlama durumudur.
- VSEPR Modeli: Küçük moleküllü bileşiklerin geometrilerini tahmin etmek için kullanılır. Örnek verecek olursak BeH2‘nin VSEPR gösterimi AX2 şeklindedir.
- İki orbitalin bağ ekseni boyunca uç uca örtüşmesi sonucu oluşan bağlara sigma bağı denir.
- İki orbitalin bağ eksenin dik olarak örtüşmesine pi bağı denir.
[Detaylı anlatım konusu: Hibritleşme ve Molekül Geometrisi]
- Elektronların birbirleri arasında kovalent bağ yapması için elektronlarını ortaklaşa kullanmaları gerekmektedir. Enerji düzeyi uyuşmayan elektronlar böyle bir durumda orbitallerini eş seviyeye getirir. Orbitallerin eş seviyeye gelmesi durumuna hibritleşme ya da melezleşme denir.
- “s” ve “p” orbitalleri kendi arasında 3 çeşit hibritleşme yapabilir. Bunlar; “sp3”, “sp2”, “sp” hibritleşmeleridir.
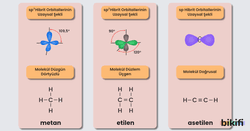
- “sp³” hibritleşmesi: Atomdaki bir s orbitaliyle üç p orbitalinin etkileşmesi sonucu meydana gelir. Örneğin; karbon atomu 2s1 ve 2p3 orbitallerini birleştirip 4 tane sp3 orbitali oluşturarak diğer atomların sp3 orbitalleriyle bağ yapabilir. sp3 hibritleşmesi yapmış bir karbon atomu çift veya üçlü bağ yapamaz.
- “sp²” hibritleşmesi: Atomdaki bir s orbitaliyle iki p orbitalinin etkileşmesi sonucu meydana gelir. sp2 hibritleşmesinde açıkta kalan bir p orbitali karbon atomunun diğer elementlerle çift bağ yapmasını sağlar.
- “sp” hibritleşmesi: Atomdaki bir s orbitaliyle bir p orbitalinin etkileşmesi sonucu meydana gelir. sp hibritleşmesinde açıkta kalan iki adet p orbitali karbon atomunun diğer elementlerle üçlü bağ yapmasını sağlar.
- Sigma bağlarında elektronlar atomun çekirdeğine daha yakın bir konumda bulunduğu için pi bağlarından daha güçlüdür.
- Sigma bağı oluşmadan pi bağı oluşmaz. İki atom arasında bir bağ varsa bu sigma bağı, birden fazla bağ varsa biri sigma diğerleri pi bağıdır.
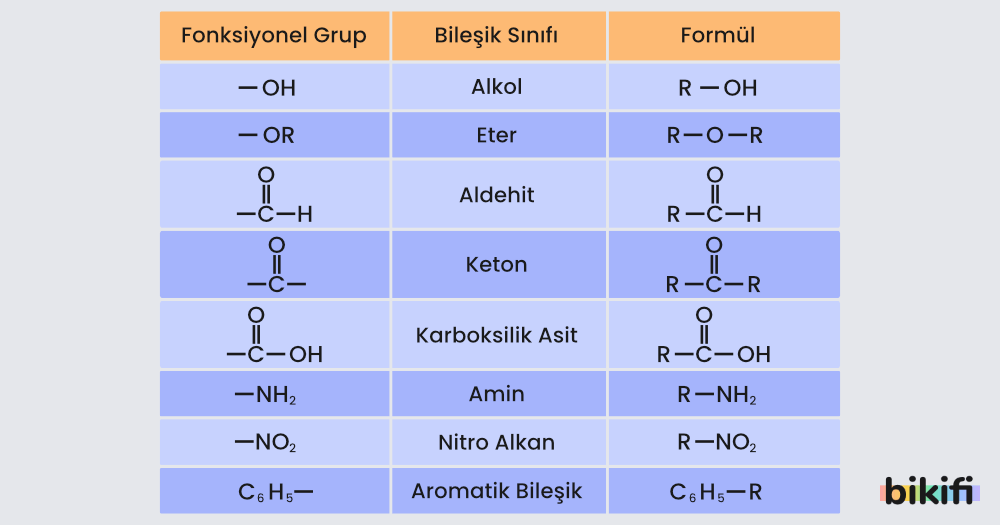
[Detaylı anlatım konusu: Fonksiyonel Gruplar]
- Hidrokarbon yapılardan bir tane hidrojen atomu ayrılmasıyla radikal olarak adlandırdığımız tanecikler oluşur.
- Radikal gruplara fonksiyonel gruplar eklenerek yeni organik bileşikler oluşturulur.
[Detaylı anlatım konusu: İzomerlik]
- Kapalı formülleri aynı, yapı formülleri farklı olan bileşiklere izomer bileşikler denir
- Zincir-dallanma izomerliği, konum izomerliği ve fonksiyonel grup izomerliği olmak üzere 3 çeşit izomerlik bulunmaktadır.
- Zincir – Dallanma İzomerliği: Alkanlarda; oluşan dallı bileşikler, aynı karbon sayılı dallanmamış bileşiğin izomerleridir. Örneğin, oktan ile metilheptan birbirlerinin zincir – dallanma izomerleridir.
- Konum İzomerliği: Organik bileşiklerde, fonksiyonel grubun farklı karbonlara bağlanmasıyla oluşan izomerliğe konum izomerliği denmektedir. Konum izomerliği aromatik bileşiklerde de meydana gelebilir.
- Fonksiyonel grup izomerliği: Bileşiklerdeki fonksiyonel grup farklı biçimlerde düzenlenebilir. Molekül formülü aynı, fonksiyonel grup atomlarının diziliş biçimi farklı olan izomerlere fonksiyonel grup izomerliği denir.
- Monoalkoller (2 karbonludan itibaren) ile eterler fonksiyonel grup izomeridir.
- Aldehitler (3 karbonludan itibaren) ile ketonlar, fonksiyonel grup izomeridir.
- Karboksilik asitler (2 karbonludan itibaren) ile ester bileşikleri fonksiyonel grup izomeri oluştururlar.
[Detaylı anlatım konusu: Hidrokarbonlar: Giriş]
- Genel olarak yapılarında “C(karbon)” ve “H(hidrojen)” içeren organik bileşiklere Hidrokarbonlar denilmektedir.
- Hidrokarbonlar ‘Alifatik’ ve ‘Aromatik’ olmak üzere iki gruba ayrılmaktadırlar.
[Detaylı anlatım konusu: Alkanlar]
- Karbon atomları arasında tekli bağ bulunduran doymuş hidrokarbonlara ‘Alkan’ denilmektedir. Genel formülleri Cn H2n+2 dir.
- Alkanlar apolar bileşiklerdir. Molekülleri arasında en etkili kuvvet “Wan der Walls” kuvvetleridir.
- Alkanlar apolar oldukları için suda yani polar çözücülerde çözünmezler.
- Alkanlarda molekül büyüklüğü arttıkça genellikle; yoğunluk, kaynama ve erime noktası artar, molekülde dallanma arttıkça kaynama ve erime noktası düşer.
- Alkanlara tepkimeye yatkın olmamaları nedeniyle Latince’de reaktivitesi az anlamına gelen “parafinler” adı verilmektedir.
- Alkan molekülünde ana zincirde 2.karbon atomuna bir metil(CH3) bağlı ise “izo” ön eki alır, eğer iki tane metil (CH3) grubu bağlı ise “neo” ön eki alır. Örneğin 2-metil propan molekülünün yaygın adı “İzobütan”dır.
- Organik kimyada çizgi halinde olmayan ve geometrik olarak başlangıcıyla sonu birbirine bağlanmış yapılara halkalı yapılar diyoruz ve bu yapıları isimlendirirken “siklo-” eki kullanıyoruz.
- Sikloalkanların genel formülleri CnH2ndir. En küçük üyesi halkalı yapının oluşabilmesi için gerekli olan minimum değer olan 3 karbonludur. 3 karbonlu sikloalkanın adı ise “siklopropan“dır.
- Alkanlar bilimsel olarak adlandırılırken aşağıdaki adımlar sırasıyla uygulanır.
- Kesintisiz en uzun karbon zinciri seçilir. Bu zincirdeki karbon sayısına denk gelen alkanın adı esas alınır. Örneğin 7 karbonlu bir zincirde adlandırma yapılırken heptan olarak sonuna ekleriz.
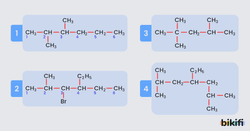
- En uzun karbon zinciri, dallanmaya yakın uçtan numaralandırılmaya başlanır. Aşağıdaki örnekte görüldüğü gibi birden fazla dallanma olduğunda dallanmanın en yakın olduğu yerden numaralandırılmaya başlanmaktadır. Görsel 1’de örnek bileşik verilmiştir.
- Dallanmanın bağlı olduğu karbona verilen numara yazılır ve araya tire (-) konulur daha sonra dallanmanın adı belirtilir. Dallanmaların sırası alfabetik şekilde olmalıdır. 3 – brom – 4 – etil – 2 metil bileşiği görsel 2 ‘de verilmiştir.
- Aynı cinsten birden fazla dallanma varsa yunanca sayısı di(2) , tri(3) ,tetra(4) , penta (5) vb. şeklinde belirtilir. Örnek olarak 2,2,4 – trimetil bileşiği görsel 3’te verilmiştir.
- En uzun karbon zincirine karşılık gelen alkanın adı adlandırmanın sonuna eklenir.
Görsel 4’te örnek olarak 4 – etil – 2,6 – dimetil heptan bileşiği verilmiştir.
[Detaylı anlatım konusu: Alkanların Kimyasal Tepkimeleri]
- Alkanlar doymuş hidrokarbonlar olduklarından katılma tepkimelerini vermezler.
- Alkanlar yalnızca yer değiştirme ve yanma tepkimelerini verirler.
- Yanma Tepkimeleri: Alkanlar yeteri kadar oksijen ile yakıldıklarında karbondioksit ve su oluşmaktadır. Alkanlar yakıldıklarında birim kütle başına açığa çıkan enerji çok büyük olduğu için yakıt olarak kullanılmaktadır.
- Yer Değiştirme Tepkimeleri (Sübstitüsyon): Güneş ışığı altında ya da yüksek sıcaklıkta alkanlar halojenlerle (genellikle Brom ve Klor) yer değiştirme tepkimesi verirler. Alkan molekülündeki bir hidrojen atomu yerine bir halojen atomu bağlanabilir. Tepkime, tüm hidrojen atomları yer değiştirinceye kadar devam etmektedir. bu yöntemle karbon tetraklorür (CCl4) elde edilebilir.
[Detaylı anlatım konusu: Alkenler]
- Alkenler karbon atomları arasında çift bağ içeren (C=C) hidrokarbonlardır. Olofinler olarak da adlandırılabilir.
- Alkenlerin genel formülü ‘dir. Eten (etilen), bu serinin en küçük üyesidir
- Fiziksel özellikleri alkanlara benzemektedir.
- İlk 3 üyesi gazdır. (eten 2 karbonlu, propen 3 karbonlu, büten 4 karbonlu) Daha sonra gelen alkenler sıvı; yapısında çok fazla karbon ve büyük molekül bulunduran alkenler ise katı fazdadır.
- Alkenler çift bağ yaptıkları için yapılarında pi bağı vardır. Pi bağı sayesinde alkanlardan kimyasal olarak daha aktiflerdir.
- Alkenler çift bağları ile iki tür tepkime verirler. Bunlardan birincisi katılma tepkimeleridir. Bu tür tepkimelerde doymamış bağ doymuş hale dönüştürülür (alkenlerden alkan eldesi). Diğer bir tür tepkime de ise çift bağın bulunduğu noktalardan kopmalar meydana gelir.
- Alkenlerin Adlandırılması şu şekilde yapılmaktadır:
- Üzerinde çift bağları da içeren en uzun karbon zinciri seçilir.
- Çift bağın yakın olduğu karbon atomundan başlayarak numaralandırma yapılır.
- Alkenlerde çift bağın bulunduğu zincire bağlı başka gruplar varsa bu grupların bağlı olduğu karbon atomu numarası ve grubun adı belirtilir.
- İki ya da daha fazla bağların bulunduğu karbon atomlarının numaraları belirtilir.
2 – Metil – 1,3 – bütadien (4 karbonlu olduğu için) - Eğer molekülde bir çift bağ varsa -en ; iki çift bağ varsa -dien; üç çiftli bağ varsa -trien son eki getirilir.
- Son olarak çift bağ taşıyan en uzun karbon zincirine karşılık gelen karbon sayısındaki alkenin ismi yazılır.
- Siklo-alkenler adlandırılırken; alkenlerdeki sistematik adlandırmanın hepsi geçerlidir.
[Detaylı anlatım konusu: Alkenlerin Kimyasal Tepkimeleri]
- Alkenler dört tür tepkime vermektedirler. Bu tepkimeler, katılma tepkimeleri, yükseltgenme, yanma ve polimerleşme tepkimeleridir.
- Katılma Tepkimeleri: Alkenlerde bulunan pi ba�ğı sigma bağından önce kırılır. Bu sayede alkenlerin yapıları bozulmadan katılma tepkimeleri verebilirler. Alkenler çok çeşitli katılma tepkimesi vermektedir.
- Hidrojen Katılması: Alkenler ve sikloalkenler metal katalizörlüğünde hidrojenle tepkimeye girerse ikili bağdaki pi bağı kırılır ve ikili bağın her iki karbon atomuna birer hidrojen bağlanır. Böylece tepkime sonucunda alkan elde etmiş oluruz. Alkenden Alkan oluşumu:
- Halojen Katılması: Alkenlere halojen katılarak dihaloalkanlar oluşur. Alkenlere katılma tepkimesine girebilecek en uygun halojenler; Brom (Br) ve Klor (Cl) dur.
- Hidrojen Halojenür Katılması: Hidrojen halojenürlerin (HCl, HBr, HI) alkenlerle tepkimesinde ikili bağdaki pi bağı açılır ve Markovnikov kuralına göre hidrojen ve halojen katılma tepkimesi verir.
- Su Katılması: Alkenlere su, asit katalizörlüğünde katılmaktadır. Markovnikov kuralı burada da uygulanır. Tepkimenin sonucunda alkol oluşmaktadır.
- Hidrojen Katılması: Alkenler ve sikloalkenler metal katalizörlüğünde hidrojenle tepkimeye girerse ikili bağdaki pi bağı kırılır ve ikili bağın her iki karbon atomuna birer hidrojen bağlanır. Böylece tepkime sonucunda alkan elde etmiş oluruz. Alkenden Alkan oluşumu:
- Yanma Tepkimeleri: Alkenlerin karbon yüzdeleri alkanlardan daha çok olduğu için alkanlara kıyasla daha parlak alevle yanmaktadırlar. Yanma ürünler su ve karbondioksittir.
- Yükseltgenme Tepkimeleri: KMnO4 bileşiği ile alkenin tepkimeye girmesiyle gerçekleşir. Bu tepkimeyi hidrokarbonlar arasında sadece alkenler gerçekleştirebilir. Bu yüzden alkenler için bir ayıraç tepkimesidir. Bu tepkimeler Bayer Tepkimesi olarak da bilinmektedir.
- Polimerleşme Tepkimeleri: Alkenler, katalizörler eşliğinde ısı ve basınç etkisi altında birbirlerine katılır ve oluşan yeni moleküllere polimer adı verilir.
[Detaylı anlatım konusu: Alkinler]
- Alkinler karbon-karbon üçlü bağını içermektedir. ile formüle edilmektedirler.
- Alkinlerin diğer bir ismi “asetilenler“dir.
- Alkinler kahverengi-turuncu rengindeki bromlu suyun rengini yok eder.
- Asetilenlerde (alkinlerde) 2 tane pi bağı 1 tane sigma bağı bulunmaktadır. Bağ açıları 180 derecedir ve sp hibritleşmesi yapmaktadırlar.
- Bu sınıf hidrokarbonların ilk üyesi 2 karbonlu asetilendir (etin).
- Alkinler içerebilecekleri hidrojen sayısından daha az hidrojen bulundurduklarından doymamış hidrokarbonlar grubuna girer.
- Alkinlerin erime ve kaynama noktaları, aynı karbon sayılı alkan ve alkenlerden daha yüksektir.
- Alkinler şöyle isimlendiriliir:
- Moleküldeki üçlü bağ birden fazla ise bunların sayısı Latince sayılarla ( 2 di, 3 tri vb.) ifade edilir.
- Üçlü bağın olduğu ve karbon sayısının en uzun olduğu karbon zinciri belirlenir, üçlü bağın yakın olduğu taraftan karbon atomları numaralandırmaya başlanır.
- Ana zincirde dallanma ya da fonksiyonel gruplar varsa alkenlerde olduğu gibi yeri ve türü belirtilir.
- Molekülde her iki uca da eşit uzaklıkta ikili ve üçlü bağ varsa ikili bağ küçük numarayı alacak şekilde numaralandırma yapılır.
- Moleküldeki üçlü bağ uca ikili bağdan daha yakınsa numaralandırılmaya üçlü bağ en küçük numarayı alacak şekilde başlanır.
- En uzun karbon zincirine sahip alkan adının sonundaki -an eki kaldırılarak yerine -in eki getirilir. Bir hidrokarbon zincirlerinde hem ikili hem üçlü bağ varsa bu bileşikler alkenin olarak adlandırılır. Alkeninlerdeki ana zincir alken olarak adlandırılır daha sonra üçlü bağ numarası ile -inolarak belirtilir.
- Örnekler:
[Detaylı anlatım konusu: Alkinlerin Kimyasal Tepkimeleri]
- Alkinler dört çeşit tepkime verirler; katılma, yanma, yükseltgenme ve polimerleşme.
- Katılma Tepkimleri: Alkinlerin katılma tepkimeleri elektrofilik katılma tepkimeleridir ve birkaç başlık altında incelenmektedir. Bütün katılma tepkimelerinde markovnikov kuralı uygulanmaktadır.
- Hidrojen Katılması: Alkinlere hidrojen katılarak alkan ya da alken elde edilir. Katılan hidrojenin miktarına göre ürün de değişir. Bu tür tepkimelerde katalizör olarak Ni (Nikel) ya da Pt ( Platin) kullanılmaktadır.
- Halojen Katılması: 1 mol alkine 1 mol halojen (Klor, Krom) katılırsa dihalojen alkenler, 2 mol halojen katılırsa tetrahaloalkanlar oluşur.
- HCl Katılması: Alkinlere hidrojen halojenür (asit) katılma tepkimesi verir, oluşan ürünler klor bağlanmış hidrokarbonlardır.
- Su katılması: 1 mol alkine H2SO4 ve HgSO4 katalizörlerinin etkisiyle 1 mol su katılınca aldehit veya keton oluşur. Eğer alkin asetilense (C2H2) katılmanın sonucunda asetaldehit oluşur. C2H2 nin dışındaki alkinlere su katılması sonucunda keton oluşur. Bu tepkimeler iki adımda gerçekleşir; ilk adım sonucu enol adı verilen kararsız alkol yapısı oluşur, ikinci adımda ise enol keton veya aldehitle bir denge tepkimesine girer. Buna tautomerlik denir.
- Yanma Tepkimeleri: Alkinler yeteri kadar oksijenle yakılabilirler. Bu tepkimenin sonucunda su ve karbondioksit oluşur
- Yükseltgenme Tepkimeleri: Alkinler asidik ortamda (genellikle H2SO4) kuvvetli yüksetgeyicilerle tepkime vererek asitlere dönüşebilmektedirler. Asetik asit eldesi
- Polimerleşme Tepkimeleri: Alkinler, aynı alkan ve alkenler gibi polimerleşebilmektedirler.
[Detaylı anlatım konusu: Aromatik Bileşiker]
- Aromatik bileşikler halkalı yapıdadır ve bağlar tek-çift olmak üzere sırasıyla dizilmiştir.
- Aromatik bileşiklerin en küçük üyesi benzendir.
- Benzen, C6H6 formülüyle gösterilen kararlı bir bileşiktir.
- Benzende bulunan bütün karbonlar sp2 hibritleşmesi yapmıştır.
- Yer değiştirme tepkimesi verebilmektedirler. Böylece benzene Cl, NO2, CH3 gibi moleküller bağlanabilir.
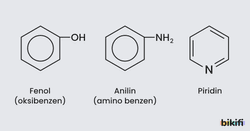
- Benzenden bir hidrojen atomu çıkarılmasıyla oluşan yapıya fenil denilmektedir. Fenile bir atom veya grup bağlandığında bunların adı okunur ve sonuna benzen eklenir.
- Grupların birbirini takip eden karbonlara bağlanması halindeki izomeri orto, bir atlayarak karbonlara yerleşmesi meta, karşılıklı karbonlarına yerleşmesi halindeki izomeri para olarak isimlendirilir.
- Benzen kullanılarak naftalin, anilin, fenol ve piridin gibi bir çok farklı aromatik bileşik elde edilebilir.