Alkenlerde çift bağ bulunmaktadır. Bu çift bağlardan birisi pi bağı diğeri sigma bağıdır. Pi bağı, sigma bağına oranla daha düşük enerjiye sahiptir. Bu nedenle alkenler kimyasal tepkimeye girmeye yatkındırlar. Alkenler dört tür tepkime vermektedirler. Bu tepkimeler, katılma tepkimeleri, yükseltgenme, yanma ve polimerleşme tepkimeleridir.
Katılma Tepkimeleri
Alkenlerde bulunan pi bağı sigma bağından önce kırılır. Bu sayede alkenlerin yapıları bozulmadan katılma tepkimeleri verebilirler. Bu tepkimelerde doymamış bağ, doymuş hale getirilir. Alkenler çok çeşitli katılma tepkimesi vermektedir.
Hidrojen Katılması
Alkenler ve sikloalkenler metal katalizörlüğünde (nikel, platin, paladyum) hidrojenle tepkimeye girerse ikili bağdaki pi bağı kırılır ve ikili bağın her iki karbon atomuna birer hidrojen bağlanır. Böylece doymuş hidrokarbon elde edilir tepkime sonucunda oluşan ürün alkandır.
Alkenden Alkan oluşumu:
Alkenlere hidrojen katılması bazen indirgenme tepkimesi olarak nitelendirilse de genellikle katalitik hidrojenlenme olarak ifade edilir.
Halojen Katılması
Alkenlere halojen katılarak dihaloalkanlar oluşur. Alkenlere katılma tepkimesine girebilecek en uygun halojenler; Brom (Br) ve Klor (Cl) dur. Flor (F) çok aktif olduğu için tepkime patlama şiddetinde hızlı gerçekleştiği için, İyot (I) ile gerçekleşen tepkimelerde ise kararlı son ürünler meydana gelmediği için uygun halojenler değillerdir.
Tepkime Detayı: Brom doymamış grupların belirtecidir. Brom tepkimesinin ilerleyişi iki aşamada olur. İlk adımda çift bağ açılır ve buraya bir elektronu eksik olan brom bağlanır. İkinci aşamada + yüklü diğer karbona elektron zenginliği olan brom bağlanmaktadır. Bu tepkimede bromun sudaki çözeltisi kullanılır, bu çözelti kırmızıdır. Tepkime sonunda suyun kırmızı rengi kaybolmaktadır. Eğer daha görsel açıklamak istersek aşağıdaki tepkime işleyişini inceleyebiliriz.
Alkenin Bromlanması:
Alkanlar bu tepkimeyi vermediği için alken ve alkanı ayırt etmede bu tepkime kullanılmaktadır. Alkenlere hidrojen ve halojen katılması radikaller üzerinden yürüyen elektrofilik bir katılma tepkimesidir.
Hidrojen Halojenür Katılması
Hidrojen halojenürlerin (HCl, HBr, HI) alkenlerle tepkimesinde ikili bağdaki pi bağı açılır. Bu tür tepkimelerin de yürüyüşü halojenlemedeki gibi iki aşamada tamamlanmaktadır. Yalnızca hidrojenin nereye bağlanacağı “Markovnikov”kuralına göre belirlenir.
Peki nedir bu Markovnikov kuralı?
Markovnikov kuralı; simetrik olmayan alkenlere simetrik olmayan moleküller katılırken katılan molekülün pozitif kısmı ikili bağ karbonlarından hidrojeni daha çok olana bağlanması olayıdır.
Propenin halojenlenmesi
Su Katılması
Alkenlere su, asit katalizörlüğünde katılmaktadır. Tepkime elektrofilik katılma tepkimesidir. Markovnikov kuralına göre Hidrojen atomunun fazla olduğu karbon atomuna Hidrojen, diğerine -OH grubu bağlanır ve tepkimenin sonucunda alkol oluşmaktadır.
Tepkimenin genel denklemi:
Yükseltgenme Tepkimeleri
Alkenler pek çok molekül ile yükseltgenle tepkimesi verir (H2O2 ve KMnO4 vb.). Alkenler bazik ortamda soğuk ve seyreltik KMnO4 ile tepkimeye girerlerse çift bağ açılır ve dioller oluşur.
Bu tepkimede KMnO4‘ün menekşe rengi kaybolur ve açık kahverengi renkli MnO2 oluşur. Bu tepkimeye bayer testi denilmektedir ve alkenlerin ayırt edilmesi amacıyla kullanılmaktadır.
Bu tepkimeyi hidrokarbonlar arasında sadece alkenler gerçekleştirebilir. Bu yüzden alkenler için bir ayıraç tepkimesidir. Bu tepkimeler Baeyer Tepkimesi olarak da bilinmektedir.
Yanma Tepkimeleri
Alkenlerin karbon yüzdeleri alkanlardan daha çok olduğu için alkanlara kıyasla daha parlak alevle yanmaktadırlar. Yanma ürünler su ve karbondioksittir. Yanma olayının genel formülü aşağıdaki gibidir.
Alkenlerin yanmasının genel tepkimesi:
Burada dikkat edilmesi gereken eşit miktarda karbondioksit ve su oluşmasıdır. Alkanlara göre farklılık göstermektedir. Ayrıca yanma tepkimeleri redoks tepkimeleridir. Alkenlerin yanmasını örnek bir soruyla açıklayalım.
Örnek: CH4 ve C2H4 gazları karışımının 1 molünün tam olarak yakmak için 2,6 mol O2 gazı gerekiyor. Karışımdaki C2H4 kaç moldür?
Çözüm: CH4 ün mol sayısına x denirse C2H4 ün mol sayısı (1-x) olur.
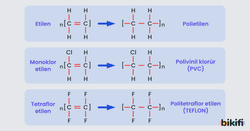
Polimerleşme Tepkimeleri
Alkenler, katalizörler eşliğinde ısı ve basınç etkisi altında birbirlerine katılır ve oluşan yeni moleküllere polimer adı verilir. Polimerler, sürekli tekrarlanan alt birimlerin oluşturduğu çok büyük moleküllü bileşiklerdir.
Küçük birimlerin her birine monomer denir. İki küçük birimin bir araya gelmesiyle oluşan yapı dimer, üç birimli moleküle ise trimer denilmektedir. Polimerler oluşurken pi bağları açılarak moleküller birbirine bağlanır. Polimerler kıyafetlerimizden evimizde kullandığımız PVC camlara kadar hayatımızın bir çok yerine mevcuttur. Polimerler laboratuvar ortamlarında üretilebilir. Ama bütün polimerler sentetik değildir. İpek, yün, nişasta doğal polimerlerdendir.
- Polietilen; tel ve kablo kaplanmasında, oyuncak, mutfak eşyası yapımında boru, film ve levha yapımında kullanılır.
- PVC; boru, döşeme yapımında, film, levha ve kaset yapımında kullanılır.
- Politetraflor etilen (Teflon); tava, tencere kaplamaları ve yalıtkan madde yapımında kullanılmaktadır.
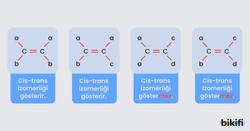
Alkenlerde Geometrik İzomeri
Alkenlerde ikili bağa sahip komşu karbon atomlarındaki aynı gruplar, bağ düzleminin aynı ya da farklı tarafında bulunduğunda iki farklı izomer yazılabilir. Çünkü bu bileşiklerde karbon-karbon arasındaki ikili bağ, bağlı olan grupların dönmesini engeller. Fakat karbon atomları arasındaki sigma bağı nedeniyle karbon atomları sigma bağı çevresinde dönme hareketi yapabilir. Bağlı grupların aynı olanları bağ düzleminin aynı tarafında ise cis (sis), zıt tarafında ise trans olarak adlandırılır. Bu izomeriye cis-trans ya da geometrik izomer denir. Dikkat etmek gereken bir nokta ise alkenlerde ikili bağın bulunduğu karbon atomlarından birine aynı iki grup bağlı ise geometrik izomer bulunmaz. Örneğin ikili bağ yapmış C atomuna 2 farklı H atomu bağlı iken diğer C atomuna C2H5 ve H bağlı ise geometrik izomeri olmaz.
Geometrik izomer, alkenlere farklı fiziksel özellikler kazandırır. Örneğin cis izomere sahip alken trans izomere göre az da olsa polar özelliktedir. Bu nedenle cis izomere sahip olan alkenin kaynama noktası trans izomere göre yüksektir.