Bu yazıyı okuyarak organik kimya (karbon kimyasına giriş, organik bileşikler) ünitesini hızlı tekrar edebilirsiniz. İstediğiniz konunun detaylı anlatımına ulaşabilirsiniz. Listeleme içerik akışına göre gidecektir. (Organik Kimya Hidrokarbonlar Detaylı Özet yazısı için burayı tıklayın)
[Detaylı anlatım konusu: Alkoller]
- Hidrokarbonlarda hidrojenlerden biri veya birkaçının yerine hidroksil grubunun (-OH) geçmesiyle oluşan bileşiklere “Alkol” denilmektedir.
- Alkollerin genel formülü R-OH veya CnH2n+1-OH şeklinde de ifade edilmektedir.
- Bir bileşiğin alkol olarak adlandırılabilmesi için bir karbon atomuna yalnızca bir hidroksil (-OH) grubu bağlanmalıdır.
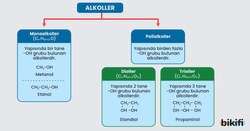
- Alkol molekülünde bulunan -OH grubu sayısında göre monoalkol ve polialkol olarak sınıflandırılmaktadır. Molekülünde bir tane hidroksil grubu bulunduran alkollere mono alkol (bir değerli) denir. Molekülünde birden fazla hidroksil grubu bulunduran alkollere poli alkol denilmektedir.
- Mono alkoller -OH grubunun bağlı olduğu karbon atomunun durumuna göre; primer, sekonder ve tersiyer olmak üzere üç grupta incelenebilir.
- Poli alkoller moleküllerinde hidroksil grubunu fazla bulundurdukları için suda kolay çözünebilirler.
- Poli alkollerin kaynama noktaları mono alkollere göre çok yüksektir.
- Poli alkoller; diol ve trioller olmak üzere iki sınıfta incelenirler
- Dioller: Moleküllerinde iki tane hidroksil grubu bulunduran alkoller dioller denilmektedir.
- Dioller: Moleküllerinde iki tane hidroksil grubu bulunduran alkoller dioller denilmektedir.
- Alkollerin fiziksel özellikleri yapılarındaki karbon atomuna bağlıdır. Molekül kütlesi artıkça alkollerin kaynama noktası artmaktadır.
- Alkoller polar bileşiklerdir. Yapılarında bulundurdukları hidroksil grubu sayesinde molekülleri arasında hidrojen bağı bulundururlar.
- Birden fazla hidroksil grubu içeren alkol moleküllerinde birden fazla hidrojen bağı oluşabilir. Bundan dolayı hidroksil grubu sayısı arttıkça kaynama noktası artar ve sudaki çözünürlük artar.
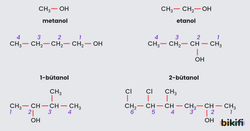
- Alkolleri adlandırırken IUPAC sistemine göre ya da özel isimleri ile adlandırmak mümkündür. Bileşikler özel adlandırma yapılırken alkolü oluşturan alkil grubu adının sonuna alkol sözcüğü getirilerek adlandırılır.
- Alkollerin IUPAC sistemine göre adlandırılmasında aşağıdaki basamaklar izlenmektedir:
- Hidroksil grubunu içeren en uzun karbon zinciri seçilir. Bu zincirdeki karbon atomu sayısı kadar karbon içeren alkanın adının sonuna -ol eki getirilir.
- Karon atomlarını numaralandırmaya hidroksil grubunun yakın olduğu uçtan başlanır.
- Ana zincirin dışındaki dallanmaların yerleri belirtilir.
Hidroksil grubunun bağlı olduğu karon atomunun numarası ana zincirin önüne yazılır. - Yapısında birden fazla hirdoksil grubu varsa -diol, -triol gibi son ekler getirilir.
[Detaylı anlatım konusu: Eterler]
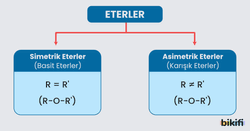
- Eterlerin genel formülünü “su molekülündeki 2 hidrojen atomunun, 2 alkil grubuyla yer değiştirmesinden oluşan bileşikler” olarak tanımlayabiliriz.
- Eter molekülündeki alkil grupları birbirinin aynı ise basit (simetrik) eter, farklı ise karışık (asimetrik) eter adı verilir.
- Eterlerin genel formülleri CHO’dur. Aynı sayıda karbon atomu içeren mono alkoller ile bir eter molekülü birbirinin izomeridir.
- Yaygın adları bağlı olduğu alkil ya da aril gruplarının isimlerinin sonuna eter kelimesi getirilerek yapılır. Genel olarak asimetrik eterler dialkil eter, asimetrik eterler de alkil-alkil eter olarak adlandırılır.
- Eterlerin sistematik adlandırması şu şekilde yapılır:
- Oksijene bağlı olan en uzun alkil grubu ana zincir olarak belirlenir.
- Belirlenen karbon zincirinde karbon atomlarının numaralandırılması, zincirin oksijen atomuna en yakın ucundan başlar.
- Oksijen atomuna bağlı olan diğer alkil grubu alkoksi olarak adlandırılır.
- Eterler polar özelliğe sahiptir. Polar yapıda oldukları için kaynama noktaları aynı karbon sayılı alkanlarınkinden yüksektir. Ancak aynı karbon sayılı alkollerden küçüktür.
- Eterler iyi birer organik çözücüdür.
- Sudaki çözünürlükleri alkollere oranla azdır. Molekül ağırlıkları arttıkça sudaki çözünürlükleri azalır.
- Eterin girdiği kimyasal tepkimelerin çoğu bağını kırar; ancak bu bağ çok kolay kırılmadığından eterlerin kimyasal tepkime etkinliği düşüktür.
[Detaylı anlatım konusu: Karbonil Bileşikleri: Aldehitler]
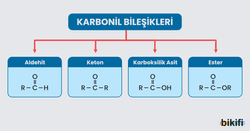
- Karbonil bileşiklerini oluşturan fonksiyonel grup; karbon atomu ile oksijen atomunun çiftli bağ yapması ile oluşan fonksiyonel gruptur. şeklinde gösterilir.
- Aldehitler, genel formülü ile gösterilir. Buradaki R radikal grubunu yani değişken grubu simgelemektedir.
- Karbonil grubu karbonu sp hibritleşmesi ile meydana gelir, üç sigma ve bir pi bağı içerir ve bu grubun bağ açısı 120° dir.
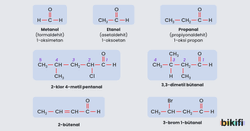
- Aldehitlerin Adlandırılması
- Yaygın Adlandırma: Aldehitlerin özel adları, karboksilli asitlerin özel adlarından türetilir. Asitlerin adları, sonundaki –oik eki kaldırılarak yerine aldehit sözcüğü getirilerek yapılır.
- Sistematik Adlandırma: IUPAC standart adlandırma kurallarına göre aldehitlerde, karbonil grubunun C atomu 1 numaralı C atomudur. Buna göre adlandırma yapılırken;
- İçinde karbonil grubu bulunduran en uzun karbon zinciri seçilir.
- Zincirdeki C atomları, karbonil grubu karbonuna 1 numara verilerek numaralandırılır.
- Zincire bağlı grup ya da atomlar, bağlı oldukları C atomu numarası ile belirlenir.
- Zincirdeki C atomu sayısı kadar karbon atomu içeren alkanın adının sonuna – al son eki getirilir.
- Karbon zincirindeki C atomları arasında ikili bağlar ya da üçlü bağlar varsa yerleri belirtilerek karbon sayısını alken ya da alkin olarak belirttikten sonra – al eki getirilir.
- Dallanmalar birden fazla ve farklı ise alfabetik sıra takip edilir.
- Aldehitler, aynı karbon sayılı alkollerden daha düşük, eterlerden ise daha yüksek sıcaklıkta kaynar.
- Aldehitler, içerdikleri hidrokarbonil grubunun özelliğinden dolayı polar yapılı moleküllerdir.
- Moleküldeki C atomu sayısı arttıkça kaynama noktaları yükselir, çözünürlükleri azalır.
- Aldehitler, karbonil grubunun polarlığı nedeniyle kimyasal tepkimelere karşı çok etkindir. Katılma ve kondenzasyon tepkimeleri verir. Karbonil grubuna bağlı hidrojen çok zayıftır. Bu nedenle aldehitler indirgen özelliğe sahiptir.
- Formaldehit, aldehitlerin ilk üyesidir. Endüstriyel olarak çok kullanılan bileşiklerden biridir. Kaynama noktası -21°C’dir. Formaldehit, aldehitlerin tüm tepkimelerini veren en reaktif aldehitlerden biridir.
- Asetaldehit renksiz, keskin kokulu ve kararsız bir sıvıdır. Kaynama noktası 21°C olduğundan kolay uçucu bir sıvıdır. Bu özelliği nedeni ile saklanması ve kullanılması zordur. Diğer alkinlere su katıldığında keton oluşur
[Detaylı anlatım konusu: Karbonil Bileşikleri: Ketonlar]
- Yapılarında aldehitler gibi karbonil grubu bulundururlar. Karbonil grubuna bağlı iki alkil kökü veya aril grubunun bağlanması sonucunda ketonlar oluşmaktadırlar.
- Ketonlar eterlerde olduğu gibi simetrik ve asimetrik olmak üzere iki grupta incelenir. Alkil kökleri aynı olan ketonlara simetrik (basit), farklı olanlara da asimetrik (karışık) ketonlar denir.
- Genel formülleri şeklindedir ve aşağıdaki gibi gösterilirler.
- Ketonların Adlandırılması
- Sistematik Adlandırma: IUPAC kurallarına göre, ketonun karbon sayısına karşı gelen hidrokarbonun adından sonra adlandırma yapılır. Bu da karbon numarası belirterek hidrokarbonun adı sonuna -on (son ek) veya keto-(ön ek) ekleri getirilerek yapılır.
- Karbonil grubunun bulunduğu en uzun karbon zinciri seçilir.
- Zincirdeki C atomları, karbonil grubunun yakın olduğu uçtan başlanarak numaralandırılır.
- Zincire bağlı grup ya da atomlar, bağlı oldukları C atomu numarası ile belirlenir.
- Karbonil grubunun bağlı olduğu karbonun numarası yazılır.
- Zincirdeki C atomu sayısı kadar karbon atomu içeren alkanın sonuna – on eki getirilir
- En uzun karbon zincirinde birden fazla karbonil grubu varsa karbonil gruplarının yeri ve sayısı belirtilir.
- Yaygın Adlandırma: Adlandırma yapılırken karbonil grubuna bağlı olan gruplar aynı ise di ön eki getirilerek bağlı grup adlandırılır ve en son keton olarak adlandırılır. Bağlı gruplar farklı ise ayrı ayrı adları ifade edilir ve en son keton olarak adlandırılır.
- Sistematik Adlandırma: IUPAC kurallarına göre, ketonun karbon sayısına karşı gelen hidrokarbonun adından sonra adlandırma yapılır. Bu da karbon numarası belirterek hidrokarbonun adı sonuna -on (son ek) veya keto-(ön ek) ekleri getirilerek yapılır.
- Ketonlarda oksijen atomuna bağl�ı hidrojen atomu olmadığından ketonlar hidrojen bağı yapamaz. Bu özellikleri nedeniyle aynı karbon sayısına denk gelen alkollerden ve asitlerden kaynama noktaları düşüktür.
- Ketonların karbon sayısı düşük olanlar suda oldukça iyi çözünür. Yüksek karbonlu ketonlar ise organik çözücülerde çözünür.
- Aldehitlerde olduğu gibi keton moleküllerinde de hidrofil ve hidrofob gruplar vardır. Bu nedenle küçük moleküllü ketonlar suda çözündükleri hâlde büyük moleküllü olanlar çözünmez.
- Ketonlar yükseltgenme-indirgenme, katılma ve yanma tepkimeleri verebilir.
- Aseton; kendine özgü kokusu olan, renksiz, kolay uçucu bir ketondur. Su ve temel organik çözücülerle iyi karışır. Kanda eser miktarda, şeker hastalarının idrarında önemli miktarda bulunur.
[Detaylı anlatım konusu: Karboksilik Asitler]
- Karboksilli asitler diğer bir isimle karboksilik asitler yapılarında karboksil grubu () bulundururlar.
- Oksijenin elektronegatifliği karbon ve hidrojene göre daha fazla olduğu için karboksil grubundaki oksijen atomları kısmen (-) negatif, karbon ve hidrojen atomları ise kısmen (+) pozitif yüklüdür; yani polar moleküllerdir.
- Genel formülleri şeklindedir. Karboksil grubundaki karbon atomu sp hibritleşmesi yapar.
- Bütün karboksilik asitler en az bir tane pi bağı içermektedir.
- Karboksilli asitler alifatik, aromatik ve siklik seriler olmak üzere üç grupta toplanır.
- Karboksilli asitler mono ve polikarboksilli asitler olmak üzere iki grupta incelenebilir.
- Monokarboksilli asitler: Moleküllerinde bir tane karboksil grubu bulunduran asitlerdir.
- Polikarboksilli asitler: Moleküllerinde birden fazla karboksil grubu bulunduran asitlerdir.
- Karboksilli asitler, IUPAC kurallarına göre, karbon sayısı bakımından karşı geldiği doymuş hidrokarbonun sonuna –oik ekiyle birlikte asit sözcüğünün getirilmesiyle adlandırılır. Diğer organik bileşiklerde olduğu gibi aşağıdaki gibi adlandırma yapılır;
- İçinde karboksil grubunu da bulunduran en uzun karbon zinciri seçilir.
- Karboksil grubunun bulunduğu karbon atomu 1 numara verilerek numaralandırılmaya başlanır.
- Zincire bağlı atom ya da grupların adı, yeri ve sayısı belirtilir.
- Ana zincirin alkan adının sonuna –oik asit eki getirilir. (metan-metanoik asit gibi)
- Karboksilli asitler özel olarak adlandırılırken asidin elde edildiği doğal kaynak esas alınmıştır. Örneğin metanoik asit karıncadan elde edilir ve özel adlandırmada formik asit olarak geçmektedir. Etanoik asit sirke asididir ve halk arasında asetik asit olarak bilinir.
- Karboksilli asitlerin fiziksel özelliklerini büyük oranda karboksil grubu belirler, karboksil grubu polar ve hidrofil bir gruptur.
- Karbon sayısı arttıkça molekülleri arasındaki çekim artar. Bunun için ilk on üyesi sıvı iken diğerleri katı hâldedir.
- Polar bileşiklerdir. İlk 4 üyesi suda iyi çözünür. Molekül büyüdükçe (karbon sayısı arttıkça) çözünürlük azalır.
- Karboksilli asitler, hidrojenin değişik koşullarda hem karboksil grubundan hem de alkil kökünden ayrılmasıyla tepkimeler verir. Ayrıca yine karboksil grubundaki hidroksilin ayrılması ile de bazı tepkimeler oluşur.
[Detaylı anlatım konusu: Karboksilik Asit Türevleri (Esterler ve Amitler)]
- Su ile tepkimeye girdiğinde karboksilli asitleri veren bileşiklere karboksilli asit türevleri denilmektedir. Karboksilli asit türevleri, karboksil grubunun hidroksilinin yerine başka grup geçmesiyle oluşur. Karboksilli asit türevleri arasında en yaygınları; açil klorürler, anhidritler, esterler ve amidlerdir.
- Açil Klorürler:
- Açil klorürler, karboksilik asitlerdaki grubu yerine klor (Cl) atomunun gelmesiyle oluşmaktadır.
- Açil klorürler kötü kokulu, tahriş edici ve uçucu sıvılardır.
- Kimyasal olarak aktif olan açil klorürler, bu sayede organik çözücülerde iyi çözünür.
- Asit Anhidritler:
- Asit anhidritler, açillendirilmiş karboksilik asitler ya da iki kez açillendirilmiş su molekülü olarak tanımlanabildiği gibi bir anorganik ve bir karboksilik asidin tepkimesi sonucu oluşabilmektedir.
- Asit anhidritler genel olarak adlandırılırken, oluşturdukları asitlerin adlarından sonra anhidrit getirilerek isimlendirilir.
- Esterler:
- Bir karboksilli asit molekülü ile bir alkol molekülünden, bir mol su çekilmesi ile oluşan maddeye ester, bu olaya da esterleşme denir.
- Esterler adlandırılırken IUPAC sistemine göre adlandırılırlar. Önce oksijene bağlı alkil grubundan sonra asit grubunun adı söylenir. Asit grubu okunurken -ik asit yerine -at eki getirilerek adlandırılma yapılabilir.
- Hoş kokuları vardır. Bu bakımdan sentetik koku yapımında kullanılır.
- Esterler hidrojen bağı yapamadıkları için alkol ve asitlere göre daha küçük kaynama noktalarına sahiptir.
- Molekül kütleleri küçük olan esterler suda çözünür. Çözünme molekül kütlesi büyüdükçe azalır. Suda çözünmeyen esterler, alkol, eter gibi organik çözücülerde çözünür.
- Çeşitli meyve öz sularında bulunur.
- Amitler:
- Amitler yapılarında grubu bulunduran bileşiklerdir.
- Amitler polar yapılı bileşiklerdir.
- Molekülleri arasında kuvvetli hidrojen bağı yaparlar.
- Erime ve kaynma noktaları yüksektir.