Karbonil bileşiklerini oluşturan fonksiyonel grup; karbon atomu ile oksijen atomunun çiftli bağ yapması ile oluşan fonksiyonel gruptur. Fonksiyonel gruptaki karbon atomu “sp2” hibritleşmesi yapmış ve oksijenle çift bağ oluşturmuştur. Karbonil bileşikleri aldehit ve ketonlar olmak üzere iki grupta incelenmektedir.
Ketonlar
Ketonların Genel Özellikleri
Yapılarında aldehitler gibi karbonil grubu bulundururlar. Karbonil grubuna bağlı iki alkil kökü veya aril grubunun bağlanması sonucunda ketonlaroluşmaktadırlar. Karbonil grubundaki karbon atomu 3 bağ yaptığı için sp2 hibritleşmesi yapmıştır. Bir pi bağı, üç tane de sigma bağı içerir ve bu grubun bağ açısı 120°’dir.
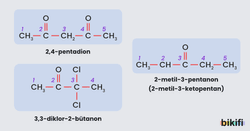
Ketonlar eterlerde olduğu gibi simetrik ve asimetrik olmak üzere iki grupta incelenir. Alkil kökleri aynı olan ketonlara simetrik (basit), farklı olanlara da asimetrik (karışık) ketonlar denir. Genel formülleri CnH2nO şeklindedir ve aşağıdaki gibi gösterilirler. Ketonların elde ediliş tepkimelerini buradaki içeriğimizden okuyabilirsiniz.
Ketonların Adlandırılması
Sistematik Adlandırma
IUPAC kurallarına göre, ketonun karbon sayısına karşı gelen hidrokarbonun adından sonra adlandırma yapılır. Bu da karbon numarası belirterek hidrokarbonun adı sonuna -on (son ek) veya keto-(ön ek) ekleri getirilerek yapılır. Adlandırma yapılırken aşağıdaki adımları izleriz;
- Karbonil grubunun bulunduğu en uzun karbon zinciri seçilir.
- Zincirdeki C atomları, karbonil grubunun yakın olduğu uçtan başlanarak numaralandırılır.
- Zincire bağlı grup ya da atomlar, bağlı oldukları C atomu numarası ile belirlenir.
- Karbonil grubunun bağlı olduğu karbonun numarası yazılır.
- Zincirdeki C atomu sayısı kadar karbon atomu içeren alkanın sonuna – on eki getirilir
- En uzun karbon zincirinde birden fazla karbonil grubu varsa karbonil gruplarının yeri ve sayısı belirtilir.
Yaygın Adlandırma
Ketonlar IUPAC adlandırmasının dışında özel olarak da adlandırılmaktadır. Özel adlandırma yapılırken; Karbonil grubuna bağlı olan diğer iki grup aynı ise simetrik ketonlar, farklı ise asimetrik ketonlar oluşur. Adlandırma yapılırken karbonil grubuna bağlı olan gruplar aynı ise di ön eki getirilerek bağlı grup adlandırılır ve en son keton olarak adlandırılır. Bağlı gruplar farklı ise ayrı ayrı adları ifade edilir ve en son keton olarak adlandırılır.
Ketonların Fiziksel Özellikleri
- Ketonlarda oksijen atomuna bağlı hidrojen atomu olmadığından ketonlar hidrojen bağı yapamaz. Bu özellikleri nedeniyle aynı karbon sayısına denk gelen alkollerden ve asitlerden kaynama noktaları düşüktür.
- Ancak karbonil grubu bulundurması nedeniyle molekülde polarlaşma olduğundan aynı karbon sayısına denk gelen alkanlardan kaynama noktaları yüksektir.
- Ketonların karbon sayısı düşük olanlar suda oldukça iyi çözünür. Yüksek karbonlu ketonlar ise organik çözücülerde çözünür.
- Ketonların kaynama noktaları, molekülleri polar olduğu için aynı molekül kütleli apolar organik bileşiklere göre daha yüksektir.
- Ancak ketonlar, alkol ve organik asit gibi molekülleri arasında hidrojen bağı oluşturan bileşiklere göre daha düşük sıcaklıkta kaynar. Çünkü keton molekülleri arasında hidrojen bağı yoktur.
- Aldehitlerde olduğu gibi keton moleküllerinde de hidrofil ve hidrofob gruplar vardır. Bu nedenle küçük moleküllü ketonlar suda çözündükleri hâlde büyük moleküllü olanlar çözünmez. Ketonlar, aldehitlere oranla daha hoş kokuludur. Sıvı ketonlar çözücü olarak boyar maddelerin hazırlanmasında kullanılır.
Bazı ketonların özellikleri aşağıdaki tabloda verilmiştir.
| Adı | Formülü | Erime Noktası | Kaynama Noktası | Yoğunluğu (20 °C) |
|---|---|---|---|---|
| Aseton | CH3COCH3 | -95 | 56 | 0,792 |
| Etil metil keton | CH3COC2H5 | -86 | 79,6 | 0,809 |
| Dietil keton | C2H5COC2H5 | -39,8 | 101,7 | 0,814 |
| 2-Heksanon | CH3COC4H9 | -57 | 128 | 0,811 |
| Pinakolon | CH3COC(CH3)3 | -49,8 | 106,3 | 0,801 |
| Benzofenon | C6H5COC6H5 | 48,1 | 305,9 | 1,146 |
Ketonların Kimyasal Özellikleri
Yükseltgenme ve İndirgenme Reaksiyonları
Ketonlarda karbonil grubunda hidrojen atomu bulunmadığından ketonlar, kolay kolay yükseltgenmez. Aldehitlerle ketonları birbirinden ayıran en önemli özellik, aldehitlerin Tolens ve Fehling belirteçleriyle tepkimeye girmesi, ketonların ise bu belirteçlerle tepkime vermemesidir.
Katılma Tepkimeleri
Ketonlar karbonil grubu polar özellik gösterir, pi bağının açılması ile katılma tepkimesi verir. Bu nedenle katılma tepkimelerinde “-” yüklü olan atom ya da gruplar yükü pozitif olan karbon atomuna, “+” yüklü olanlar ise yükü negatif olan oksijen atomuna bağlanır. Ketonlara halojen “X” katılmaz.
Ketonlara nikel ya da platin katalizörlüğünde hidrojen katılırsa ikincil alkoller elde edilir. Bu tepkime ketonların indirgenme tepkimesidir.
Yanma Tepkimeleri
Ketonlar da diğer organik bileşikler gibi yandığı zaman CO2 ve H2O verir. Ketonların genel yanma tepkimesi ve örneği aşağıdaki gibidir.
Aseton
Aseton; kendine özgü kokusu olan, renksiz, kolay uçucu bir ketondur. Su ve temel organik çözücülerle iyi karışır. Kanda eser miktarda, şeker hastalarının idrarında önemli miktarda bulunur. Yağları, reçineleri, plastik ve selüloz türevlerini çözer. Aldehitlere benzer şekilde polimerizasyon tepkimesi verir. 3 mol aseton molekülü kondenzasyonla birleşerek trimetilbenzeni oluşturur.