Karboksilik asitlerin fonksiyonel grubu karboksil grubudur. Bu ad karbonil ve hidroksil gruplarından türetilmiştir. Karbonil grubuna bir hidroksil grubu bağlanması ile oluşan yapıya karboksil grubu, bu grubu taşıyan R–COOH yapısındaki bileşiklere ise karboksilik asitler denir.
- Oksijenin elektronegatifliği karbon ve hidrojene göre daha fazla olduğu için karboksil grubundaki oksijen atomları kısmen (-) negatif, karbon ve hidrojen atomları ise kısmen (+) pozitif yüklüdür; yani polar moleküllerdir.
- Genel formülleri CnH2nO2şeklindedir. Karboksil grubundaki karbon atomu sp² hibritleşmesi yapar.
- Bütün karboksilik asitler en az bir tane pi bağı içermektedir.
- Karboksilli asitler alifatik, aromatik ve siklik seriler olmak üzere üç grupta toplanır.
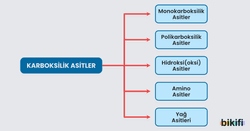
Karboksilik Asitlerin Sınıflandırılması
Monokarboksillik asitler
Moleküllerinde bir tane karboksil grubu bulunduran asitlerdir.
Örnek olarak HCOOH: Formik asit, CH3–COOH: Asetik asit
Polikarboksillik asitler
Moleküllerinde birden fazla karboksil grubu (–COOH) bulunduran asitlerdir. Polikarboksilik asitlerin değerliği yapısında bulunan karboksil (–COOH) sayısına eşittir.
Örnek olarak: Etandioik asit, Propandioik asit, Sitrik asit
📚 Ek Bilgi:
Okzalik Asit : Okzalik asit, kuzukulağı bitkisinin yapraklarında bulunur. Bu yaprakların ekşi tadını okzalik asit verir.
Malonik Asit : 136 °C’de eriyen, su ve alkolde çok çözünen kristal bir maddedir. Monoklor asetik asidin potasyum siyanür ile etkileşmesine siyano asetik asidi verir. Bu da hidrolizlenince malonik asit elde edilir.
Suksinit Asit : Kehribar asidi veya amber asidi de denir. Erime noktası 185 °C’dir. Suda % 6 oranında çözünür. Meyvelerde bulunur. İlk kez doğal bir reçine olan kehribarın ısıtılması ile elde edilmiştir.
Malik Asit : Bir dikarboksilli hidroksi asittir. Elma asidi olarak da bilinir. Malik asidin (+) ve (-) olmak üzere iki optikçe aktif izomerisi vardır. Optikçe aktif olanın erime noktası 101 °C’dir. Suda çok çözünür.
Tartarik Asit : Meyvelerde, özellikle üzümde çok bulunur. Üzümden şarap elde edilirken şarap tortusu olarak fermantasyon tankının çeperlerinde potasyum bitartarat hâlinde oluşur. Buradaki potasyum bitartarattan elde edilen tartarik asit optikçe aktiftir. Polarize ışığı sola çevirir.
Sitrik Asit : Limon asididir. Limonun ekşi tadını verir. Bir trikarboksilli hidroksi asittir. Asimetrik karbonu olmadığından optikçe aktif değildir. 135 °C’de erir. 100 g suda 240 g sitrik asit çözünür.
Hidroksi (Oksi) Asitler
Yapılarında –OH grubu bulunan asitlerdir. R–CH(OH)–COOH genel formülüne sahiptir. Hidroksi asitler meyve asitleridir. Glikolik asit şeker kamışından, laktik asit ekşi yoğurttan, mandelik asit acı bademden, malik asit elmadan, sitrik asit limon veya ıhlamurdan elde edilir.
Amino Asitler
Yapılarında –NH2 (amino) grubu bulunduran asitlerdir. R–CH(NH2)–COOH genel formülüne sahiptir.
Amino asitler canlılarda birçok fonksiyonu yerine getirir. Bunların en önemlisi amino asitlerin proteinlere ait polipeptit zincirlerinin yapı taşları olmalarıdır. Doğadaki sayılarının fazlalığına rağmen sadece 20 amino asit vücudumuzdaki proteinlerin yapısına katılır.
Örnek olarak: Glisin, Alanin, Serin
Yağ Asitleri
Çift karbon sayılı ve düz zincirli monokarboksilik asitlerdir.
Örnek olarak: Bütanoik asit, Hekzanoik asit, Oktanoik asit
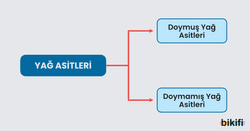
Yağ asitleri aşağıda gösterildiği gibi ikiye ayrılır.
Doymuş ya da doymamış yağ asitleri bitkisel veya hayvansal ürünlerden elde edilir. Yapılarında çift sayıda karbon atomu vardır ve düz zincirlidir.
Doymamış Yağ Asitleri: Karbon zincirinde pi bağı bulunan yağlara doymamış yağ denir. En önemli doymamış yağ asitleri 18 tane karbon atomu içerir. Yapısında bir tane çift bağ (=) bulunan 18 karbonlu doymamış yağ asidi oleik asittir. Formülü CH3–(CH2)7–CH=CH–(CH2)7–COOH şeklindedir.
Doymuş Yağ Asitleri: Yaygın olarak kullanılan doymuş yağ asitlerinde 12-18 arasında çift sayıda karbon atomu bulunur. Doymuş yağ asitleri karbon atomları arasında pi bağı içermez. Et, deniz mahsulleri, süt ürünleri, hindistan cevizi gibi besinler doymuş yağ asitleri açısından zengindir. Doymuş yağ asitleri, doymamış yağ asitlerinin hidrojen katılarak doyurulmasından elde edildiğinden katı hâldedir. Zeytinyağı, ayçiçeği yağı, margarin gibi bitkisel yağlar doğrudan kolesterol içermez. Doymuş yağlar vücudumuza girdikten sonra kolesterol üzerinde etkili olur.
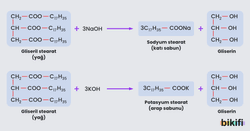
Bitkisel ve hayvansal yağların kuvvetli bazlarla karıştırılarak uygun sıcaklıkta ısıtılmasıyla oluşan tuza sabun, bu olaya da sabunlaşma denir. Bu işlem sırasında yağları oluşturan trigliseritler kendisini oluşturan yağ asitlerine ve gliserine parçalanmaktadır. Yağ asitleri, kullanılan sodyum hidroksit (NaOH) veya potasyum hidrokside (KOH) bağlı olarak sodyum ve potasyum tuzuna dönüşmektedir. Gliserin ise yan ürün olarak açığa çıkmaktadır.
Sabun, yağ asitlerinin sodyum veya potasyum tuzlarından oluşur. Gliseril stearatın NaOH ile oluşturduğu sabun, beyaz (katı) sabundur. Gliseril stearatın KOH ile oluşturduğu sabun, halk arasında arap sabunu olarak bilinen yumuşak sabundur.
Karboksilik Asitlerin Adlandırılması
Sistematik Adlandırma
Karboksilli asitler, IUPAC kurallarına göre, karbon sayısı bakımından karşı geldiği doymuş hidrokarbonun sonuna –oik ekiyle birlikte asit sözcüğünün getirilmesiyle adlandırılır. Diğer organik bileşiklerde olduğu gibi aşağıdaki gibi adlandırma yapılır;
- İçinde karboksil grubunu da bulunduran en uzun karbon zinciri seçilir.
- Karboksil grubunun bulunduğu karbon atomu 1 numara verilerek numaralandırılmaya başlanır.
- Zincire bağlı atom ya da grupların adı, yeri ve sayısı belirtilir.
- Ana zincirin alkan adının sonuna –oik asit eki getirilir. (metan-metanoik asit gibi)
Karboksilik asitlerin adlandırılması örnekleri aşağıdaki gibidir.
Özel Adlandırma
Karboksilli asitler özel olarak adlandırılırken asidin elde edildiği doğal kaynak esas alınmıştır. Örneğin metanoik asit karıncadan elde edilir ve özel adlandırmada formik asit olarak geçmektedir. Etanoik asit sirke asididir ve halk arasında asetik asit olarak bilinir. Karboksilli asitlerin özel adlandırmalarına bazı örnekler aşağıdaki gibidir.
| Asidin Formülü | IUPAC adı | Yaygın Adı | Doğal Kaynak |
|---|---|---|---|
| HCOOH | Metanoik Asit | Formik Asit | Karınca |
| CH3COOH | Etanoik Asit | Asetik Asit | Sirke |
| CH3CH2COOH | Propanoik Asit | Propiyonik Asit | Süt |
| CH3(CH2)2COOH | Bütanoik Asit | Bütirik Asit | Tereyağı |
| CH3(CH2)3COOH | Pentanoik Asit | Valerik Asit | Kediotu Kökü |
Karboksilik Asitlerin Genel Elde Edilme Yolları
Karboksilli asitler başlıca birincil alkollerin ya da aldehitlerin yükseltgenmesiyle, Grignard bileşiklerinden ve esterlerden elde edilir.
Birincil (primer) Alkollerin Ya da Aldehitlerin Yükseltgenmesiyle
Birincil alkollerin bir basamak yükseltgenmesiyle aldehitler oluşur, aldehitlerin de bir basamak yükseltgenmesiyle karboksilli asitler oluşurlar. Yükseltgen madde olarak KMnO4 ya da K2Cr2O7 kullanılmaktadır. Sekonder alkollerin yükseltgenmesi sonucu ketonlar oluşur ancak ketonlar yükseltgenmediği için karboksilli asit oluşturmazlar.
Grinard bileşiği üzerinden karbondioksit geçirilmesi ile
Grignard bileşiklerinin karbondioksit ile tepkimesi sonucu magnezyum karboksilat (R-COOHMgX) oluşur. Bu oluşan bileşiğin asitli ortamda hidrolizi ile karboksilli asitler meydana gelirler.
Grinard bileşiği üzerinden karbondioksit geçirilmesi ile elde yöntemi aşağıdaki gibidir.
Bu yönteme grignard bileşiklerinin karbonlanması da denir. Görüldüğü gibi elde edilen asitlerdeki karbon sayısı, hazırlandı�ğı grignard bileşiklerinin karbon sayılarından bir fazladır.
Esterlerden Karboksilli Oluşumu
Esterler asitli ortamda su ile hidroliz edilirse alkol ve asit oluşur. Aşağıda örneği görülmektedir.
Karboksilli Asitlerin Fiziksel Özellikleri
Karboksilli asitlerin fiziksel özelliklerini büyük oranda karboksil grubu belirler, karboksil grubu polar ve hidrofil bir gruptur.
- Karbon sayısı arttıkça molekülleri arasındaki çekim artar. Bunun için ilk on üyesi sıvı iken diğerleri katı hâldedir.
- Polar bileşiklerdir. İlk 4 üyesi suda iyi çözünür. Molekül büyüdükçe (karbon sayısı arttıkça) çözünürlük azalır.
- Karboksilli asit molekülünün arasında iki hidrojen bağı oluşur, bu olaya dimerleşme denir.
- Karboksilli asitler zayıf asitlerdir. Suda çözündüklerinde kısmen iyonlaşırlar. Hidrojen iyonları molar derişimi ve pH değerleri denge sabitlerinden hesaplanır.
- Karboksilli asitlerin kaynama noktası aynı karbon sayılı alkollerden ve aldehitlerden daha yüksektir.
Bazı karboksilli asitlerin önemli özellikleri aşağıdaki tabloda verilmiştir.
| Adı | Formülü | Erime Noktası (°C) | Kaynama Noktası(°C) | Yoğunluk (20 °C’de) |
|---|---|---|---|---|
| Formik asit | HCOOH | 8,4 | 100,5 | 1,220 |
| Asetik asit | CH3COOH | 16,6 | 118 | 1,049 |
| Propiyonik asit | CH3CH2COOH | -22 | 141 | 0,992 |
| n-butirik asit | CH3CH2CH2COOH | -4,3 | 163,5 | 0,958 |
| İzobutirik asit | (CH3)2CHCOOH | -46,1 | 153,2 | 0,968 |
| n-valerik asit | CH3(CH2)3COOH | -34,5 | 87 | 0,939 |
| Kaproik asit | CH3(CH2)4COOH | -2 | 205 | 0,927 |
| Kaprilik asit | CH3(CH2)6COOH | -16,5 | 239,3 | 0,909 |
| Kaprik asit | CH3(CH2)8COOH | 31,5 | 270 | 0,886 |
| Laurik asit | CH3(CH2)10COOH | 44 | 1311 | 0,868 (50 °C) |
Karboksilli Asitlerin Kimyasal Özellikleri
- Karboksilli asitler, hidrojenin değişik koşullarda hem karboksil grubundan hem de alkil k�ökünden ayrılmasıyla tepkimeler verir. Ayrıca yine karboksil grubundaki hidroksilin ayrılması ile de bazı tepkimeler oluşur.
- Karboksilli asitler zayıf asitlerdir. Ka değerleri 10-4 ile 10-5 arasında değişmektedir. Asitlik dereceleri karbonik asit ve sudan daha güçlüdür. Bu nedenle Na2CO3 ve NaOH gibi alkali bikarbonat ve hidroksitlerle tuz oluşturur. Bu tepkimeleri sonucu CO2 gazı açığa çıkar.
- Karboksilli asitler ile alkoller, aralarından bir mol su ayırarak esterleri oluşturur.
- Karboksilli asitler; fosfor tri klorür, fosfor penta klorür ve tiyonil klorür gibi etkin reaktiflerle asit klorürleri, açil klorürleri oluşturur.
- Karboksilli asitlerin LiAlH4 ile indirgenmeleri sonucu birincil alkoller oluşur.
- İki molekül karboksilli asitten, bir molekül su çekilmesi ile asit anhidritleri oluşur. Anhidritler, asit türevlerinden hazırlanabileceği gibi doğrudan doğruya asitlerden de hazırlanabilir.
Karboksilli Asitlerin Asitliği
Karboksilik asitler zayıf asitlerdir. Suda kısmen iyonlaşırlar. Monokarboksilik asitlerin asitlik kuvveti moleküldeki Karbon sayısının artmasıyla azalır. Monokarboksilik asitlerin en kuvvetlisi formik asittir.
Formik Asit
Karboksilli asitlerin ilk üyesi olan formik asit, keskin ve batıcı bir kokuya sahiptir. Deriye temas ettiğinde tahriş edicidir. Suda çok çözünür. Karıncaların salgıladığı öz suda ve ısırgan otunun öz suyunda bulunur. Esterlerin genellikle güzel kokuları vardır. Bu özelliğinden dolayı parfüm endüstrisinde kullanılır. Tortu giderici olarak kullanılan formik asit ayrıca uçak sanayinde kullanılmaktadır. Endüstride karbon monoksit gazının basınç altında sodyum hidroksit ile ısıtılmasından elde edilir.
Optikçe Aktiflik ve Optik İzomeri
Sol elinizi bir aynanın karşısına tutarsanız eliniz ve aynadaki görüntüsü üst üste çakışmaz. Sol elin aynadaki görüntüsü sağ el gibi görünür. Kendi ayna görüntüsü ile üst üste çakışmayan herhangi bir moleküle asimetrik molekül denir. Asimetrik molekül ve bunun ayna görüntüsü, değişik bileşiklerdir ve bu bileşiklerin her birine enantiyomerler denir.
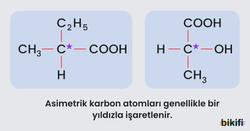
Asimetrik Karbon Atomu
Asimetrik bir molekülün en önemli yapısal özelliği, moleküldeki bir karbon atomuna dört farklı grubun bağlanmış olmasıdır. Böyle bir molekül asimetriktir ve molekülün optik izomerisi vardır. Dört farklı grubun bağlanmış olduğu karbon atomuna asimetrik karbon atomu adı verilir.