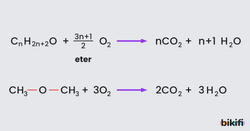
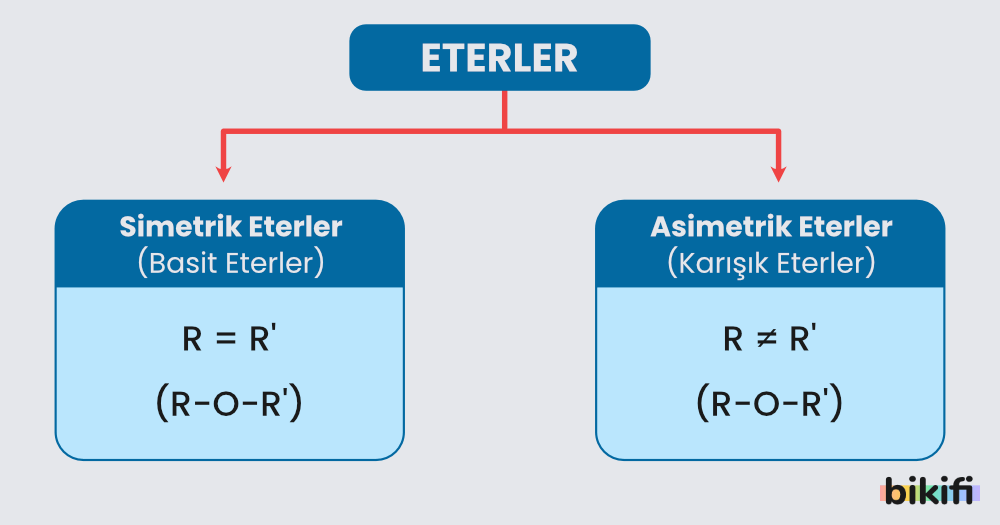
Eterlerin genel formülünü “su molekülündeki 2 hidrojen atomunun, 2 alkil grubuyla yer değiştirmesinden oluşan bileşikler” olarak tanımlayabiliriz. Eter molekülündeki alkil grupları birbirinin aynı ise basit (simetrik) eter, farklı ise karışık (asimetrik) eter adı verilir. Eterlere, bir kez alkillenmiş alkol ya da iki kez alkillenmiş su türevleri olarak da bilinir.
Eterlerin genel formülleri CnH2n+2O’dur. Aynı sayıda karbon atomu içeren mono alkoller ile bir eter molekülü birbirinin izomeridir. Bu nedenle eterlerle alkollerin genel formülleri aynıdır.
Eterlerin Adlandırılması
Yaygın Adlandırma
Eterlerin sistematik adlarının kullanımı pek yaygın değildir. Genellikle yaygın isimleri kullanılır. Yaygın adları bağlı olduğu alkil ya da aril gruplarının isimlerinin sonuna eter kelimesi getirilerek yapılır. Alkil ya da aril gruplarının adları alfabetik sıraya göre yazılır. Genel olarak asimetrik eterler dialkil eter, asimetrik eterler de alkil-alkil eter olarak adlandırılır. Örnekler aşağıdaki gibidir.
Sistematik Adlandırma
IUPAC sistemine göre adlandırma şu şekilde yapılır.
- Oksijene bağlı olan en uzun alkil grubu ana zincir olarak belirlenir.
- Belirlenen karbon zincirinde karbon atomlarının numaralandırılması, zincirin oksijen atomuna en yakın ucundan başlar.
- Oksijen atomuna bağlı olan diğer alkil grubu alkoksi olarak adlandırılır.
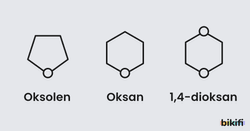
Halkalı yapıya sahip ticari yönden önemli pek çok eter bulunmaktadır. Halkalı eterleri adlandırırken oksijenin bir karbon atomu yerine geçtiği düşünülür ve buna göre adlandırma yapılır. Adlandırmada oksa ön eki kullanılır.
Eterlerin Fiziksel Özellikleri
- Eterler polar özelliğe sahiptir. Polar yapıda oldukları için kaynama noktaları aynı karbon sayılı alkanlarınkinden yüksektir.
- Eterler iyi birer organik çözücüdür.
- Kaynama noktaları aynı karbon sayılı alkollerden küçüktür.
- Sudaki çözünürlükleri alkollere oranla azdır. Molekül ağırlıkları arttıkça sudaki çözünürlükleri azalır.
- Kimyasal tepkimelere karşı isteksizdirler.
- Kolay tutuşurlar.
Bazı eterlerin özellikleri aşağıdaki gibidir.
| Adı | Formülü | Erime Noktası °C | Kaynama Noktası °C | Yoğunluğu (20°C) |
|---|---|---|---|---|
| Metil eter | CH3OCH3 | -138,5 | -23 | -0,661 |
| Etil eter | CH3CH2OCH2CH3 | -116,2 | 34,5 | 0,714 |
| Di-propil eter | (CH3CH2CH2)2O | -122 | 91 | 0,736 |
| İzopropil alkol | (CH3)2CHOCH(CH3)2 | -60 | 69 | 0,735 |
| Metil etil eter | CH3OCH2CH3 | – | 10,8 | 0,697 |
| Vinil eter | H2C=CHOCH=CH2 | – | 35 | – |
| Fenil eter | C6H5OC6H5 | 27 | 258 | 1,075 |
Eterlerin Kimyasal Özellikleri
Eter moleküllerinde bulunan oksijenin elektronik yapısıyla sudaki oksijenin elektronik yapısı aynıdır. Bu yüzden eter molekülleri de su molekülleri gibi doğrusal geometri oluşturamaz. Eterin girdiği kimyasal tepkimelerin çoğu C ─ O bağını kırar; ancak bu bağ çok kolay kırılmadığından eterlerin kimyasal tepkime etkinliği düşüktür.
Na (sodyum) ile tepkime vermez, ancak derişik HI ve HBr asitleri ile tepkime verebilir.
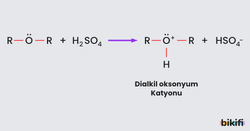
Eterler, suda çözünmedikleri hâlde sülfirik asit ve hidro iyodik asit gibi asitlerde çözünürler.
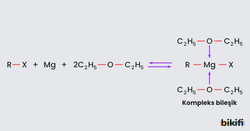
Grinard bileşiğinin hazırlanmasında kullanılan eterler magnezyum iyonu ile aşağıdaki kompleks bileşiğini oluşturur.
Eterlerin Çözücü Özellikleri
Eterler; seyreltik asitler, bazlar ve sık kullanılan yükseltgen ve indirgenlerle genellikle tepkime vermez. Çünkü yapısında bulunan C–O bağı kolay kopmaz. Bu nedenle eterler kimyasal tepkimelere karşı oldukça ilgisiz (inert) bileşiklerdir. Organik reaksiyonlarda çözücünün reaksiyona katılmaması önemlidir. Polarlığının az olması nedeniyle eterler, organik maddeler için iyi bir çözücüdür
Eterlerin Kullanım Alanları
Eterler çoğunlukla analitik kimya ve tıp alanında kullanılır. Dietileterin (lokman ruhu) kaslar üzerinde gevşetici etkisi vardır. Bu nedenle eskiden anestezik olarak kullanılmıştır. Ancak dietileter; nabzı, solunumu ve kan basıncını etkiler, solunum yollarını tahriş eder, mide bulantısı yaparak kusmaya sebep olur. Bu yan etkilerinden dolayı eterlerin anestezide kullanımı azalmaktadır
Dietil Eter
Eter denildiği zaman çoğunlukla akla dietil eter gelir. Bu bileşik uzun yıllardır bilinmekte olup 1842 yılında tıp alanında bayıltıcı olarak kullanılmaya başlanmıştır. Dietil eter 35 °C’de kaynamaya başlayabilen renksiz ve kendine ait kokusu olan akıcı bir sıvıdır. Halk arasında lokman ruhu olarak bilinmektedir. Grignard bileşikleri üretilirken kullanılırlar. Dietil eter, etil alkolden H2SO4 katalizörlüğünde su çekilmesi ile elde edilir.
Eterlerde İzomeri
Kapalı formülleri aynı açık formülleri farklı olan eterlere izomer eterler denilmektedir. Aynı karbon sayılı mono alkoller ile eterler fonksiyonel grup izomeridir. Aşağıda bazı örnekler verilmiştir.
Aynı sayıda karbon atomu içeren bir mono alkol ile eter molekülü birbirinin izomerleridir. Bu nedenle alkol ve eterlerin kapalı formülleri aynıdır.
📚 Ek bilgi: Eterlerin Eldesi
Alkollerden Eter Eldesi
Asit katalizli olarak genellikle H2SO4 kullanılır. İki mol alkolden asit katalizörlüğünde 140°C’de gerçekleşen dehidrasyon senteziyle eter elde edilmektedir. Bu yolla simetrik eterler saf olarak elde edilebildiği gibi asimetrik eterler de elde edilir. Tepkimenin genel formülü aşağıdaki gibidir.
Simetrik eterlerin elde edilişi ise aşağıdaki gibidir.
Williamson Senteziyle
Alkolatların alkil halojenürlerle verdiği yer değiştirme tepkimesi sonucu eter oluşumu gözlemlenir. Bu yöntem iki basamakta gerçekleşir. Tepkime baz katalizörlüğünde gerçekleşir. Karışık (asimetrik) eter elde edilmesinde bu yöntem kullanılmaktadır. Bu yöntemde sodyum alkolat ile alkil halojenür tepkimeye sokulur. Tepkime aşağıdaki gibi gerçekleşir.
Bu yöntemde dallanmış alkil halojenür kullanılırsa eterden çok daha fazla alken elde edilir. Bu yüzden Williamson sentezinde yüksek eter elde etme oranı için seçilecek alkil halojenürün dallanmamış yapıda olması tercih edilir.