Alkinler yapısında üçlü bağ bulundurmaktadır. Kimyasal tepkimeye girerken bu bağlar açılır. Alkinler, alkenlere benzer şekilde tepkime vermektedirler. Alkinler dört çeşit tepkime verirler; katılma, yanma, yükseltgenme ve polimerleşme.
Katılma Tepkimeleri
Alkinlerin katılma tepkimeleri elektrofilik katılma tepkimeleridir ve birkaç başlık altında incelenmektedir. Bütün katılma tepkimelerinde markovnikov kuralı uygulanmaktadır.
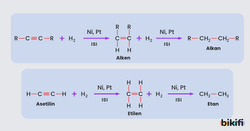
Alkinlere Hidrojen Katılması
Alkinlere hidrojen katılarak alkan ya da alken elde edilir. Katılan hidrojenin miktarına göre ürün de değişir. Örneğin; 1 mol alkine, 2 mol H2 katılarak alkan elde edilirken 1 mol H2 katılsaydı alken elde edilecekti. Bu tür tepkimelerde katalizör olarak Ni (Nikel) ya da Pt (Platin) kullanılmaktadır.
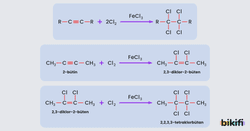
Alkinlere Halojen Katılması
1 mol alkine 1 mol halojen (Klor, Brom) katılırsa dihalojen alkenler, 2 mol halojen katılırsa tetrahaloalkanlar oluşur. Halojen katılmasında; demir (III) klorürün (FeCl3) katalitik etkisiyle halojenler elektrofilik olarak birincisi hızlı ikincisi yavaş olmak üzere iki basamakta katılırlar.
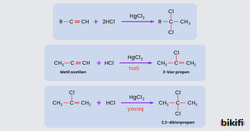
Alkinlere Halojen Asidi (HCl) Katılması
Alkinlere hidrojen halojenür (asit) katılma tepkimesi verir, oluşan ürünler klor bağlanmış hidrokarbonlardır. Alkinlere 1 mol ya da 2 mol hidrojen halojenür katılabilir. Bu tepkime türü HgCl2 katalizörlüğünde gerçekleşir.
Alkinlere Su Katılması
1 mol alkine H2SO4 ve HgSO4 katalizörlerinin etkisiyle markovnikov kuralına göre 1 mol su katılınca aldehit veya keton oluşur. Eğer alkin asetilense (C2H2) katılmanın sonucunda asetaldehit oluşur. C2H2 nin dışındaki alkinlere su katılması sonucunda keton oluşur. Bu reaksiyon iki basamakta gerçekleşir. İlk basamakta enol adı verilen kararsız ve doymamış alkoller oluşur. İkinci basamakta bu enol, ketona dönüşür.
Bu dönüşümde izomer olan enol ve keton arasında denge kurulur. Bu dengenin ismi enol-keto tautomerisidir. Molekülün temel iskeletinde büyük değişiklik olmadan hidrojen atomu yer değiştirdiğinde buna bağlı olarak ikili ve üçlü bağın da yeri değişirse yeni oluşan bileşik ile eskisi arasında bir denge meydana gelir. Buna tautomerlik denir. Yukarıdaki keto-enol tautomerliğinde enoldeki –OH’ın hidrojeni keto bileşiğindeki karbona geçmiş ve çift bağların da yeri değişmiştir.
Yanma Tepkimeleri
Alkinler yeteri kadar oksijenle yakılabilirler. Bu tepkimenin sonucunda su ve karbondioksit oluşur. Alkinlerin yanma tepkimelerinin genel formülü aşağıdaki gibidir.
Alkinler yeterli oksijenle yanarsa CO2 ve H2O oluşur. Alkinlerin yanmasının genel formülü:
Yükseltgenme Tepkimeleri
Alkinler asidik ortamda (genellikle H2SO4) kuvvetli yükseltgeyiciler ile tepkime vererek asitlere dönüşebilmektedirler.
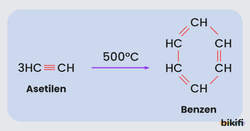
Polimerleşme Tepkimeleri
Alkinler, aynı alkan ve alkenler gibi polimerleşebilmektedirler. Alkinlerin ilk üyesi olan asetilen trimerleşerek benzen yapısını oluşturur.
Asetilen:
- Alkinlerin ilk üyesidir.
- Renksizdir ve oda koşullarında gazdır fazdadır.
- Asetilen oksijen ile yakıldığında alev sıcaklığı 3000 °C yi aştığı için demircilik işlerinde kullanılır.
Yer Değiştirme Tepkimeleri
Asetilen, amonyaklı AgNO3 çözeltisiyle tepkime vererek beyaz çökelek oluşturur. Amonyaklı AgNO3 (Tollens ayıracı) önce [Ag(NH3 )2]+ kompleks iyonunu, sonra asetilenle tepkimeye girerek suda çözünmeyen beyaz renkli çökelek oluşturur.
Asetilen, amonyaklı CuNO3 çözeltisiyle tepkime vererek kırmızı çökelek oluşturur. Amonyaklı CuNO3 (Fehling ayıracı) önce [Cu(NH3 )2] + kompleks iyonunu oluşturur, sonra asetilenle tepkimeye girerek suda çözünmeyen kırmızı renkli çökelek oluşturur.
Asetilen bileşiği Fehling ve Tollens ayıraçlarıyla yer değiştirme tepkimesi vererek metal asetilenür tuzlarını oluşturmuştur. Bu tuzlar darbelere karşı dayanıksızdır ve patlayıcı özellik gösterir.