Gazların basınç, sıcaklık, hacim ve miktar değişkenleri arasında bir takım ilişkiler bulunmaktadır. Bu özel ilişkilere gaz yasası denmektedir ve bu ilişkinin gözlemlendiği gazlara ideal gaz denir. Gerçek durum ele alındığında, hiçbir gaz ideal değildir. Fakat çoğu gaz düşük basınç ve yüksek sıcaklıklarda ideal gaz modeline uyarlar.
Gözlemsel Gaz Yasaları
Gaz yasaları bilim insanlarının yürüttüğü çalışmaların birleştirilmesiyle oluşturulmuştur. Bu çalışmalara gözlemsel gaz çalışmaları denilmektedir. Gözlemsel gaz çalışmalarında gazın 4 özelliği [basınç (p), sıcaklık (T), hacim (V) ve mol sayısı (n)] arasındaki ikili ilişkileri üzerinde çalışmalar yapılmıştır. Aşağıda 4 bilim adamının yaptığı çalışmalara göz atabilir veya bütün çalışmaların birleşimiyle oluşturulan ideal gaz denklemini bir sonraki bölümde görebilirsiniz.
Basınç – Hacim İlişkisi (Boyle Yasası)

Gazların basınç-hacim ilişkisi 1660 yılında İngiliz bilim adamı Robert Boyle tarafından incelenmiştir. Boyle yapmış olduğu çalışmalar sonucunda sabit miktardaki ve sabit sıcaklıktaki bir gazın hacim azalmasına tepki olarak basıncının arttığını gözlemlemiştir.
Boyle Yasası: Sabit sıcaklıkta ve belirli bir miktar gazın hacmi, basıncıyla ters orantılıdır ve şu şekilde formülize edilir:
P1V1= P2V2= k1
Denklemdeki;
- P1: Gazın ilk durumdaki basıncını
- P2: Gazın son durumdaki basıncını
- V1: Gazın ilk durumdaki hacmini
- V2: Gazın son durumdaki hacmini
- k1: Gazın sıcaklığına ve miktarına göre oluşturulan bir değişkeni
temsil eder.
Sıcaklık – Hacim İlişkisi (Charles Yasası)
Gazın sıcaklık ve hacmi arasındaki matematiksel ilişki 1787 yılında İngiliz bilim adamı Charles tarafından bulunmuştur. Charles yapmış olduğu deneylerde sabit miktarlarda herhangi bir gazın sıcaklık değişimine aynı oranda tepki verdiğini gözlemlemiştir.
Charles Yasası: Sabit basınçtaki belirli miktardaki gazın hacmi, mutlak sıcaklık değişimiyle orantılı olarak değişir ve şu şekilde formulüze edilir:
V1T2 = V2T1 = k2
Denklemdeki;
- T1: Kelvin biriminden gazın ilk durumdaki sıcaklığını
- T2: Kelvin biriminden gazın son durumdaki sıcaklığını
- V1: Gazın ilk durumdaki hacmini
- V2: Gazın son durumdaki hacmini
- k2: Gazın basıncına ve miktarına göre oluşturulan bir değişkeni
temsil eder.
Sıcaklık – Basın�ç İlişkisi (Gay – Lussac Yasası)
Gazların sıcaklık ve basınç ilişkisi 19. yy’ın başlarında Fransız bilim insanı Joseph Gay-Lussac tarafından bulunmuştur.
Gay – Lussac Yasası: Sabit miktardaki ve hacimdeki bir gazın sıcaklığını arttırdığımızda gazın ortalama kinetik enerjisini (sıcaklığını) arttırdığımız için; gaz parçacıkları, gazın tutulduğu kabın duvarlarına daha çok çarpışır ve böylece basıncın artmasını sağlar. Yasa şu şekilde formulüze edilir:
P1T2 = P2T1 = k3
Denklemdeki;
- T1: Kelvin biriminden gazın ilk durumdaki sıcaklığını
- T2: Kelvin biriminden gazın son durumdaki sıcaklığını
- P1: Gazın ilk durumdaki basıncı
- P2: Gazın son durumdaki basıncı
- k3: Gazın hacmine ve miktarına göre oluşturulan bir değişkeni
temsil eder.
Hacim – Miktar İlişkisi (Avogadro Yasası)
Avogadro Yasası: Sabi sıcaklık ve basınçta gazların eşit hacimleri eşit sayıda molekül içerir. Yani belirtilen koşullarda gaz hacminin yarıya düşmesi gaz miktarının da yarıya düşmesi demektir. Avogadro yasası şu şekilde formulüze edilir:
V1n2 = V2n1 = k4
Denklemdeki;
- V1: Gazın ilk durumdaki hacmini
- V2: Gazın son durumdaki hacmini
- n1: Mol cinsinden gazın ilk durumdaki miktarını
- n2: Mol cinsinden gazın son durumdaki miktarını
- k4: Gazın basıncına ve sıcaklığına göre oluşturulan bir değişkeni
temsil eder.
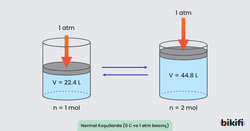
Normal Şartlar
Avogadro yasası sayesinde normal şartlar olarak adlandırılan (0°C ve 1 atm basınçta) koşullarında bulunan bir ideal gazın miktarını ve hacmini bilebiliriz. Normal şartlar altında bir mol gaz (6,02 x 1023 tane) 22.4 L hacim kaplar.
İdeal Gaz Denklemi
Gay-Lussac yasası, Boyle yasası ve Charles yasası, birlikte toplam gaz yasası’nı ortaya çıkarırlar. Bu yasaya bir de Avogadro yasası’nın eklenmesi, ideal gaz yasasını ortaya çıkarır. Gerçekte hiçbir gaz tamamen ideal gaz gibi davranmaz, çünkü bir gazın ideal gaz olarak kabul görmesi için aşağıdaki iki kabullenmeye uyması gerekir.
- Bir tek gaz molekülünün hacmi toplam hacmin yanında ihmal edilebilecek kadar küçüktür
- Moleküller arası çekim kuvveti yok denecek kadar azdır.
Yukarıdaki dört formulün birleşmesiyle ideal gaz denklemi oluşturulur. İdeal gaz denklemi şu şekilde formulüze edilir:
PV = nRT
Denklemdeki;
- P: İdeal gazın herhangi bir durumdaki basıncını (atm biriminden)
- V: İdeal gazın hacmini (litre cinsinden)
- n: İdeal gazın mol sayısını
- R: İdeal gaz sabitini
- T: İdeal gazın kelvin sıcaklığındaki değerini
temsil eder.
İdeal Gaz Sabiti
İdeal gaz sabiti 0,082 (L.atm/mol.K) olarak alınır. Değerin bulunuşu normal şartlar altında yapılan hesaplamalardan gelir. Eğer basınç paskal cinsinden, hacim m³ cinsinden ve sıcaklık kelvin cinsinden alınırsa ideal gaz sabiti 8,31 (J/mol.K) olarak bulunur.