Kinetik teoriye göre gazlar, hızla hareket eden, molekülleri arasında büyük boşluklar olan ve birbirleriyle her oranda karışabilen moleküllerdir. Gazların sıkıştırılabilir yapısı günlük hayatımızda pek çok noktada kullanılır.
!Not: Gazlar�ın birbiri içerisinde tamamen homojen şekilde dağılması, yer çekimsiz ortamda mümkündür. Ancak lise seviyesinde yapılan çözümlerde yer çekimi etkisi denklemlere yansıtılmaz.
Gazların Tanımlayıcı Özellikleri
Gazlar tanımlanırken, basınç, hacim, gaz miktarı ve sıcaklık kavramları kullanılır.
Basınç (P)
Gazlar kütleleri ve hareketlerinden dolayı içinde bulundukları kaba çarparlar. Bu çarpmanın etkisiyle gaz basıncı oluşur. Basıncı bilimsel olarak P harfiyle gösteririz. Birimi N/m² (newton/metre kare) veya (Pa) pascaldır
Atmosferde bulunan gazların uyguladığı basınca, atmosfer basıncı denir. Atmosfer basıncı, deniz seviyesinden yükseklere çıkıldıkça azalır ve sıvıların kaynama noktasına etki eder (atmosfer basıncı azaldıkça sıvının kaynama noktası da azalır – detay: “buhar basıncı ve kaynama noktası arasındaki ilişki“).
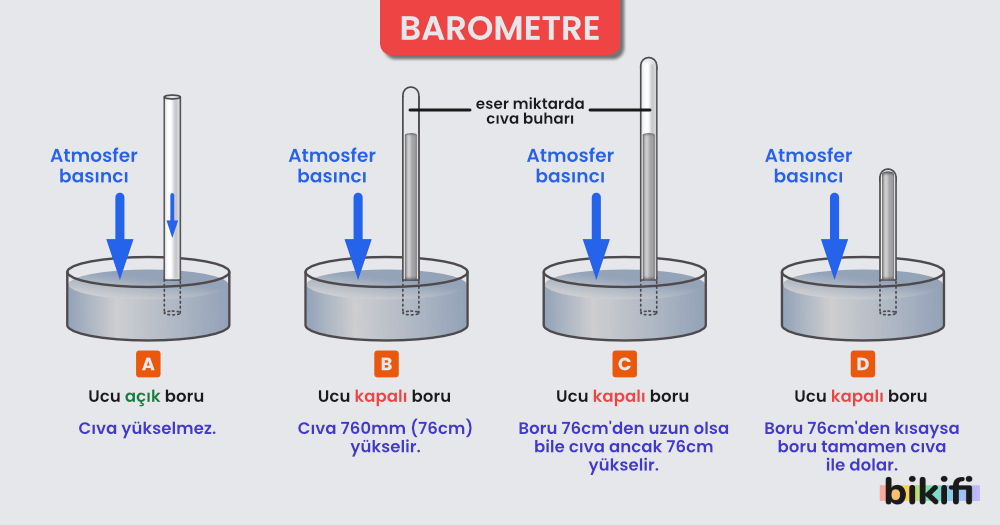
Gazlarda Basıncın Ölçülmesi
Gazların basıncı barometre olarak adlandırılan Torricelli (1608-1647) tarafından geliştirilen aletlerle ölçülür. Pa birimi kimyasal ölçümlerin yapılmasını zorlaştırır, bu yüzden milimetre civa (mmHg) veya atmosfer (atm) basıncı daha sık kullanılır. mmHg, Toricelli adından hareketle Torr olarak da adlandırılır.
Gazların basıncını ölçülmesi katı ve sıvı fazların basınç ölçümüne gere daha dolaylı yoldan yapılır. Barometreler, atmosfer basıncını civanın borudaki yükselme miktarı sayesinde ölçerler. Deniz seviyesinde yapılan bir atmosfer basıncı ölçme deneyinde atmosfer basıncı (normal şartlar altında) 760 mmHg bulunacaktır.
Hacim (V)
Gazlar bulundukları kabın hacmini alırlar. Birimi litredir (L). 1 m³ = 1000 dm³ = 1000 L denklemini kullanarak hacmi litreye çevirebilirsiniz. Gazların hacimleri doğrudan ölçülememekle birlikte, sabit basınç ve sabit sıcaklıkta laboratuvar şartları altında deney düzenekleri yardımıyla hacim ölçümü yapılabilir. 1 atm basınç altında ve 0°C derecede (normal şartlar altında) bir mol gaz (6,02 x 1023 tane) 22.4 L hacim kaplar.
Gaz Miktarı (n – Mol)
Gazların miktarı kimyada çok sık kullanılan mol sayısı kavramıyla ölçülür ve n harfi ile gösterilir. Örneğin 12 gr saf karbon içeren bir gaz 6.02 X 1023 tane karbon atamu içerir ve bu sayı 1 mole eşittir. 6,02 X 1023 sayısına avagadro sayısı denmekte ve NA ile gösterilmektedir.
Detaylara ilerleyen konularda gireceğiz. Daha fazla bilgi için buraya bakın.
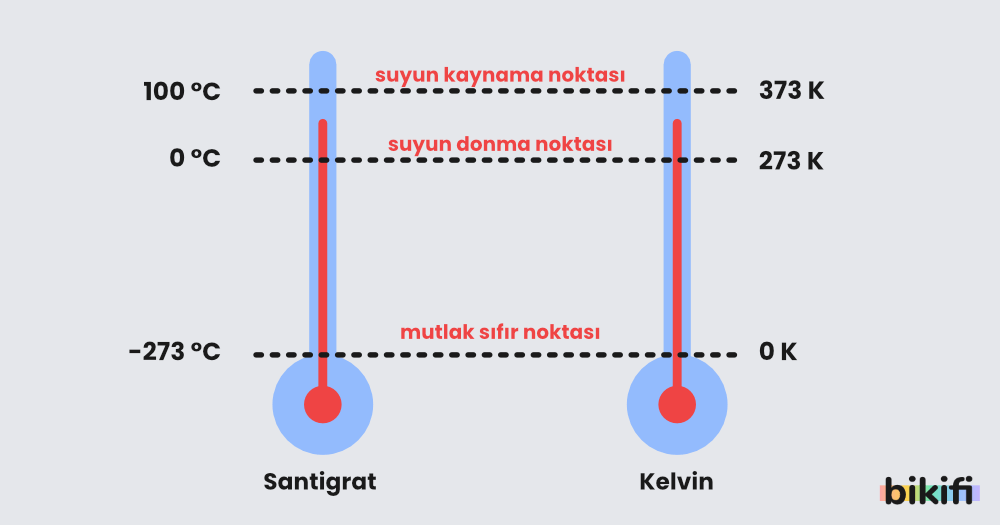
Sıcaklık (T – Kelvin)
Bilimsel olarak sıcaklık kelvin sisteminde ölçülür ve mutlak sıcaklık olarak da isimlendirilir. Bilimsel olarak 0 (sıfır) Kelvin derecede atomların ve moleküllerin bilinen tüm hareketleri durar. 0 Kelvin sıcaklığının altına düşmek teorik olarak mümkün değildir. Bu yüzden kelvin ölçümleri mutlaka pozitif çıkmalıdır. Celsiyus sıcaklığını kelvin birimine dönüştürmek için aşağ�ıdaki bağıntı kullanılır.
Kelvin (K) = Celcius (°C) + 273
Detaylı konu anlatımı için: Gazların genel özellikleri (11. sınıf)













