Karışımı oluşturan maddelerin karışımın her noktasına eşit oranda dağılması ile oluşan karışıma homojen karışım denir. Homojen karışımlara çözelti denir. Dışarıdan bakıldığında homojen karışımlar tek bir madde gibi görünürler.
Karışımı oluşturan maddeler her oranda karışabilir veya sıcaklık ve basınca bağlı olarak belirli oranlarda da karışabilirler.
Çözeltiler, çözücü ve çözünen adı verilen bileşenlerden oluşur. Tuz su karışımında tuz çözünen, su çözücü ve tuzlu su ise çözeltidir. Çözeltideki bileşenlerden genellikle miktarı fazla olana çözücü, miktarı az olana çözünen denir. Fakat bu tanımlama her zaman çözeltiler için geçerli olmayabilir. Bazen çözücü daha az, bazı koşullarda ise çözücü ve çözünen arasındaki kütlesel fark çok azdır. Gaz çözeltileri bu tür çözeltilere örnek verilebilir. Gaz tanecikleri arasında etkileşim kuvvetleri yok denecek kadar azdır. Bu nedenle gaz tanecikleri her zaman birbirleriyle homojen olarak ve her oranda karışabilir.
İki ya da daha çok metalin, bir metal ile yarı metalin, bazen bir metal ile ametalin eritilip karıştırılmasıyla oluşan karışımlara alaşım denir. Alaşımlar genelde katılar arasında oluşan homojen ya da heterojen karışımlardır.
Çözeltiler, çözücü ve çözünenin fiziksel hallerine göre sınıflandırılır. Homojen karışımlarda çözücü ve çözünen katı, sıvı ve gaz halde olabilir.
Çözeltiler katı, sıvı ve gaz çözeltiler olmak üzere üçe ayrılır. Çözeltinin fiziksel halini çözücü belirler. Çözücü; katı ise katı çözelti, sıvı ise sıvı çözelti, gaz ise gaz çözelti adını alır.
Çözeltilerde çözücü ve çözünen kütlesinin toplamı çözelti kütlesine eşittir. Ancak çözücü ve çözünenin hacimleri toplamı çözelti hacmine eşit değildir.
Moleküler Düzeyde Çözünme Süreci
Maddelerin çözünmesi iyonik veya molekül olarak meydana gelir. Maddelerin iyonik ya da molek�üler olarak çözünme sürecini maddelerin yapısı yani aralarında oluşturdukları etkileşimler belirler.
Not:
Çözücünün su olması durumunda çözünen madde taneciklerinin molekülleri tarafından sarılmasına hidrasyon,su dışındaki bir çözücü tarafından sarılmasına solvasyon denir. Hidrasyonun ve solvasyonun her ikisine sıvı sarılım da denir.
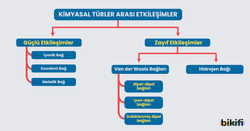
Tanecikler Arası Etkileşimler ve Çözünme Olayı
Bir maddenin çözücü içinde çözünüp çözünmediğini tanecikler arası etkileşim kuvvetleri belirler. Tanecikler arası etkileşimler, madde türüne göre değişir. Maddelerin birbiri içinde çözünmesi türler arası zayıf etkileşimlere bağlıdır. Çözünme sürecinde çözücü ve çözünen arasında; hidrojen bağları, dipol – dipol, iyon – dipol, dipol – indüklenmiş dipol, indüklenmiş dipol – indüklenmiş dipol (London kuvvetleri) oluşabilir.
- Polar çözücüler ve iyonik bileşikler arasında iyon – dipol etkileşimi oluşur. Örneğin; sofra tuzunun(NaCl) suda çözünmesi, çözücü ve çözünen tanecikleri arasında oluşan iyon-dipol etkileşimlerinin sonucudur. Yani NaCl’nin ve iyonları ile polar molekül olan ‘nun kısmi yükleri arasındaki iyon-dipol etkileşimi oluşur.
- Polar çözücülerin polar çözünenleri çözmesi dipol-dipol etkileşimi ile gerçekleşir. Örneğin; hidrojen klorür (HCl) bileşiğinin suda çözünmesi sırasında, çözücü ile çözünen arasında dipol-dipol etkileşimleri oluşur.
- Apolar çözücülerin apolar maddeleri çözmesi sırasında çözücü ile çözünen tanecikleri arasında London kuvvetleri oluşur. Örneğin gibi apolar moleküller birbiri içinde çözündüğünde aralarında London kuvvetleri oluşur.
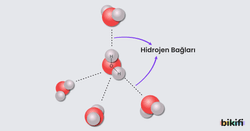
- Şeker, suda moleküler olarak çözünür. Şekerin suda çözünmesi sırasında şeker molekülleri ve su molekülleri arasında hidrojen bağı kurulur. Su molekülleri, şeker moleküllerinin arasında girerek şeker moleküllerinin suda dağılmasını sağlar. Böylece şeker moleküllerinin suda çözünmesini sağlar.
Apolar molekül ile polar moleküller aralarında dipol – indüklenmiş dipol etkileşimi oluşur. Örneğin , suda dipol – indüklenmiş dipol etkileşimi oluşturarak az miktarda çözünür. Dipol – indüklenmiş dipol çok zayıf etkileşim olduğu için apolar moleküllerin polar moleküllerdeki çözünmesi ihmal edilir.
İyonik bileşikler ile apolar moleküller arasında iyon – indüklenmiş dipol etkileşimi oluşur. Örneğin KCl iyonik bileşiğinin apolar molekül olan ‘deki çözünme sürecinde iyon-indüklenmiş dipol etkileşimi oluşur. İyon-indüklenmiş dipol çok zayıf etkileşim olduğundan iyonik bileşiğin apolar moleküllerdeki çözünmesi ihmal edilir.
Çözücü – Çözünen Benzerliği
Benzer benzeri çözer. Çoğunlukla polar maddeler polar çözücülerde, apolar çözücüler apolar çözücülerde iyi çözünür. Apolar maddelerin polar çözücülerde çözünmesini bekleyemeyiz.
Apolar maddeler arasında sadece indüklenmiş dipol-indüklenmiş dipol zayıf etkileşimleri oluşur. Polar moleküller arasında ise hidrojen bağı, dipol-dipol etkileşimi ve London kuvvetleri oluşur. Bunlardan en güçlüsü hidrojen bağı en zayıfı London kuvvetleridir. Maddeleri karıştırdığımızda tanecikler arasında hidrojen bağı oluşuyor ise maddeler birbiri içinde iyi çözünür. Hidrojen bağı oluşturarak çözünen maddeler moleküler olarak çözünür.
benzeri polar yapılı moleküller kendi aralarında ve birbiri ile hidrojen bağı, dipol-dipol etkileşimleri ve London kuvvetleri oluşturur ancak bu etkileşimlerden en güçlü olan hidrojen bağı olduğu için çözünme olayında hidrojen bağı etkilidir.
benzeri bileşiklerin molekül yapıları polardır. Bu moleküller birbirleriyle ve polar su molekülleriyle dipol-dipol etkileşiminde çözünür.
gibi apolar yapılı maddelerin kendi molekülleri arasında sadece London kuvvetleri vardır ve bu moleküller birbirleri içinde çözünürken molekülleri arasında London kuvvetleri oluşur. Örneğin katı maddesi, sıvısında iyi çözünmesinin nedeni iki molekülün de apolar olmasındandır.
✍ NOT I: Karışımların tanecikleri arasındaki etkileşimler karışımın kaynama noktası, donma noktası, buhar basıncı, uçuculuk gibi birçok özelliklerini etkiler.
✍ NOT II: Elektrik akımını elektrolit adı verilen çözeltiler iletebilir. Elektrolit çözeltiler suda kısmen veya tamamen iyonlaşarak çözünen maddelerin çözeltileridir. Tuzlu su en yaygın örnektir. Elektrik akımını suda moleküler çözünen maddeler iletemez ve bu tür çözeltilere elektrolit olmayan çözeltiler denir. Şeker suda moleküler çözündüğü için şekerli su elektriği iletmez.
✍ NOT III: Çözeltiyi oluşturan molekülün kütlesi, toplam elektron sayısı arttıkça moleküller arasındaki London kuvvetleri artar ve bu durum moleküllerin erime, kaynama noktasını yükseltir.
Çözeltilerde Çözünmüş Madde Oranları
Derişim (konsantrasyon), bir çözücü ya da çözeltide bulunan çözünen madde miktarıdır. Yani bir çözeltinin konsantrasyon değeri, o çözeltide ne kadar çözünmüş maddenin bulunduğunun ifadesidir ve çözeltinin tam olarak tanımlanmasında önemlidir.
- Hava, deniz suyu, gazoz, benzin, mazot, kolonya çözeltilere örnek olarak verilebilir.
- Çözeltilerde derişim değerini bilmek içerdiği madde miktarını bilmek demektir.Çok temel bir örnek suyun Ph değerini, sertliğini,kokusunu, tadını bu değerlerle kontrol altında tutabiliriz.
- Derişim birimi olarak en çok kullanılanlar; molarite, kütlece % derişim, hacimce % derişim, ppm (milyonda bir), molalite ve mol kesri gibi birimlerdir.
Derişik ve Seyreltik Çözeltiler
Birim hacimde çözünen madde miktarı çok, çözücüsü çözünene oranla az olan çözeltilere derişik çözelti denir.Az miktarda çözünmüş madde içeren yani çözücüsü çok çözeltilere ise seyreltik çözelti denir. Derişik ve seyreltik çözelti, genellikle çözeltilerin derişimlerini kıyaslarken kullanılır. Tek bir çözeltiye bakarak o çözeltinin derişik mi seyreltik mi olduğuna karar veremeyiz.
Bu değerler bağıl değerlerdir. 100 g suda çözünen 30 g şekerli çözelti çözüneni çözücüden az olmasına rağmen seyreltik değildir. Hatta ve hatta bu çözelti 100 g suda 10 g şeker ile oluşturulan çözeltiden daha derişiktir.
Derişik bir çözeltiye çözücü ilavesi ile seyreltilebilir. Seyreltik çözelti çözünen eklenerek veya çözücü uzaklaştırarak derişik hale getirilebilir.
Kütlece Yüzde, Hacimce Yüzde ve ppm Derişimleri
Kütlece yüzde derişim 100 g çözeltide çözünmüş maddenin gram cinsinden miktarına denir ve aşağıdaki bağıntı ile hesaplanır.
Aynı çözeltiler kar�ıştırıldığında oluşan kütlece yüzde derişim formülü ile bulunur.
Hacimce Yüzde Derişim
Sıvı-sıvı çözeltilerde kullanılan derişim birimidir. Çözeltiyi oluşturan sıvıların hacimleri arasındaki oran hacimce yüzde derişim ile belirlenir.
100 mL çözeltide çözünenin mL olarak hacmine hacimce yüzde derişim denir.
Örneğin 10 mL etil alkol 40 mL suda çözündüğünde hacim 50 mL olur. Bu çözeltinin hacimce yüzde derişimi;
Hacimce yüzde derişim = =%40 olur.
Aynı çözeltiler karıştırıldığında oluşan çözeltinin hacimce yüzde derişimi formülü ile hesaplanabilir.
Örnek soru çözümü için şu yazıdaki ilgili bölüme bakabilirsiniz: Karışımlar Anahtar Kavramlar ve Soru Çözümü
ppm (parts per million = milyonda bir kısım)
Çözeltilerde bir bileşenin kütle ya da hacim yüzdesi çok küçük ise çözelti derişimi genellikle başka birimlerle belirtilir. Örneğin 1 mg/L’lik bir çözeltide çözünen miktarı 0,001 g/L’ dir. Bu derecede seyreltik bir çözeltinin yoğunluğu ile suyun yoğunluğu hemen hemen aynıdır. Bu nedenle, 1000 g çözeltide 0,001 g çözünen içeren bir çözeltinin derişimi ile 1 000 000 g çözeltide 1 g çözünen içeren bir çözeltinin derişimi aynıdır. Bu çözeltinin derişimini milyonda bir kısım (ppm) şeklinde belirtmek daha anlaşılır olmasını sağlar. 1 ppm= 1 mg/L’dir. Örneğin 1 litre suda 2 mg iyonu çözündüğünde derişimi 2 ppm denir.
Çok hassas ölçümlerde derişimler çok küçük olur ve derişim birimi olarak kütlece yüzde derişim birimi yerine ppm kullanılır. Havayı kirleten karbon dioksit, sudaki çözünmüş iyon derişimleri ve ilaçlardaki etken madde derişimleri ppm olarak verilir.
Çözeltilerin Koligatif (sayısal) Özellikleri
Çözeltilerin fiziksel özellikleri onları oluşturan çözücü ve çözünen maddelerin fiziksel özelliklerinden farklıdır. Çözeltilerin fiziksel özellikleri çözünen madde türüne ve derişimine bağlıdır. Bir çözeltide, çözünmüş maddenin kimyasal yapısına bağlı olmayıp çözeltinin birim hacimdeki toplam tanecik sayısına bağlı olan özelliklere koligatif özellikler (sayısal özellikler) denir. Kısacası çözeltinin derişimine bağlı özelliklere denir.
- Kaynama noktası yükselmesi
- Donma noktası düşmesi
- Buhar basıncı düşmesi
- Osmotik basınç gibi özellikler örnek verilebilir.
Çözeltilerde Donma, Kaynama noktası ve Osmotik Basınç
Kaynama noktası, saf maddeler için ayırt edici bir özellik olup sahip bir değerdir. Çözeltilerin sabit bir kaynama noktası yoktur. Deniz seviyesinde saf su 100 C de kaynarken tuzlu su için sabit kaynama noktasından bahsedilemez.
Aynı sıcaklıkta uçucu sıvıların tanecikler arası çekim kuvvetleri uçucu olmayan sıvıların çekim kuvvetinden düşüktür. Bu nedenle çözüneni uçucu olmayan çözeltilerin buhar basıncı, aynı sıcaklıkta saf çözücünün buhar basıncından düşük olur. Sıvının buhar basıncının dış basınca eşit olduğunu sıcaklığa kaynama noktası denir.
Uçucu bir sıvı içine uçucu olmayan çözünen ilave edildiğinde oluşan çözeltide çözücü ve çözünen arasında etkileşimler oluşur. Sıvı tanecikleri arasındaki etkileşim daha güçlü hale gelir ve sıvının gaz fazına geçmesi zorlaşır. Çözücü çözünen etkileşimi, çözeltinin buhar basıncını azaltarak kaynama noktasını artırır. Sıvı-katı çözeltilerin kaynama noktası saf çözücülerden yüksek, buhar basıncı ve donma noktası düşüktür. Saf suyu incelediğimizde 1 atm basınç altında 100 °C’de kaynar, 0 °C’de donar. Suya tuz eklediğimizde oluşan tuzlu su çözeltisi 1 atm basınçta 100°C’nin üzerinde kaynar ve 0 °C’nin altında donar.
Tuzlu su çözeltisi veya başka bir çözelti ısıtılmaya devam edilir ise çözücü azalır ve çözelti derişimi artar. Bu durum kaynama noktasını yükseltir ve çözelti sıcaklığı yükselmeye devam eder. Bir süre sonra çözelti doyma noktasına ulaşır ve birim hacimde çözünen miktarı artmaz. Böylece çözelti doyma noktasına ulaştığında sabit sıcaklıkta kaynamaya devam eder.
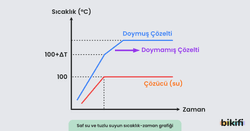
Deniz seviyesinde saf suyun ve doymamış tuzlu su çözeltisinin kaynama grafikleri aşağıdaki grafikte görülebilir.
Mavi çizgi grafiğinde 100+ΔT sıcaklığına kadar olan kısım doymamış tuzlu su çözeltisinde sıcaklık yükselmesini ifade eder ve sonraki bölümde doymamış çözelti kaynamaya başlar. Buharlaşan çözücü sebebiyle çözeltinin derişimi artar ve doyma noktasına ulaştığında grafik yatay konuma geçer çünkü doymuş çözeltiler sabit sıcaklıkta kaynar. Bu noktada buharlaşan çözücü sebebiyle bir miktar tuz katılaşır.
Çözeltilerde çözücü tanecillerin kristalleşerek katı hale geçmesi için birbirine yaklaşması gerekir fakat çözünen madde tanecikleri bunu engeller. Donma noktasının saf halden daha düşük olmasına ve sabit olmamasına sebep olur.
Koligatif özellikler, çözeltinin derişimine bağlıdır. Bir çözeltide derişim arttıkça kaynama noktası artar, donma noktası ise düşer
Osmoz
Derişimi farklı iki karışımın yarı geçirgen zarla ayrılması ile derişimin az olduğu taraftan çok olan tarafa geçmesine osmoz denir. Suyun oransal olarak bol olduğu taraftan yani çözünenin az olduğu yönden suyun bol olduğu yöne geçmesidir.
Osmozda derişimi büyük olan ortam derişimi küçük olan ortamdaki çözücüye bir emme kuvveti uygular. Bu kuvvete osmotik basınç denir. Bitkilerden su, köklerden yukarıya osmotik basınç ile yani derişim farkından doğan emme kuvvetiyle taşınır.
Az yoğun ortamdan çok yoğun ortama su geçmesiyle çok yoğun ortamda sıvı seviyesi yükselir. Ozmotik basınç ne kadar büyükse yoğun ortamdaki sıvı seviyesinin yüksekliği de o kadar büyüktür.