Maddeler atom ya da molekül adı verilen çok küçük taneciklerden oluşur. Bu taneciklerin birbiriyle etkileşimleri sonucu maddenin özellikleri ortaya çıkar. Moleküller arası etkileşimleri anlamak, maddelerin davranışlarını ve özelliklerini anlamamıza yardımcı olur. Maddelerin katı, sıvı veya gaz gibi farklı hallerde bulunmasının sebebi, moleküller arasındaki bu etkileşimlerdir.
Basit bir örnek olarak televizyon veya bilgisayar ekranlarının üzerine zamanla yapışan tozları düşünebiliriz. Ekran çalışırken, ekranda oluşan elektrik yükü küçük toz parçalarını kendisine çeker. İşte moleküller arasındaki etkileşimler de bu örnekteki gibi küçük elektrik yüklerinin birbirini çekmesi veya itmesi esasına dayanır.
Moleküller Arası Etkileşim Türleri
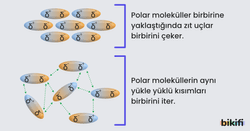
Moleküller arasındaki etkileşimlerin temel sebebi, zıt elektrik yüklerinin birbirini çekmesi ve aynı elektrik yüklerinin birbirini itmesidir. Bu etkileşimlere genel olarak elektrostatik etkileşimler denir.
Moleküller arası etkileşimler temel olarak iki çeşide ayrılır:
- Van der Waals Kuvvetleri: London kuvvetleri, dipol-dipol etkileşimleri ve dipol-indüklenmiş dipol etkileşimleri içerir.
- Hidrojen Bağı: Özellikle güçlü bir dipol-dipol etkileşimidir.
Etkileşimlerde Kullanılan Kavramlar
- İyon
- İyon, bir atom veya molekülün elektron alması veya vermesi sonucunda oluşan elektrik yüklü parçacıklardır.
- İyonlar iki türlüdür:
- Katyon: Pozitif yüklü iyon (örneğin; Na⁺, Ca²⁺)
- Anyon: Negatif yüklü iyon (örneğin; Cl⁻, O²⁻)
- Dipol
- Dipol, bir molekülün yapısında pozitif ve negatif yüklerin farklı noktalarda yoğunlaşmasıyla oluşan kutuplaşmış moleküldür.
- Polar molekül olarak da bilinir.
- Dipollerde, molekülün bir tarafı kısmen pozitif (δ⁺), diğer tarafı ise kısmen negatif (δ⁻) yüklenir.
- Örnek: Su molekülü (H₂O). Oksijen atomu (δ⁻), hidrojen atomları (δ⁺) yüklenmiştir
- İndüklenmiş Dipol
- Normalde polar olmayan bir molekülün, dışarıdan gelen elektrik yükü ya da dipol molekülünün etkisiyle geçici olarak polar hâle gelmesidir.
- Bu olayda molekül içinde yük dağılımı kısa süreliğine bozulur ve anlık bir dipol oluşur.
- Geçici dipol olarak da adlandırılır.
- Örnek: İyot molekülü (I₂) polar değildir, ancak yanına polar bir molekül yaklaştığında kısa süreliğine yük dağılımı bozulur ve geçici bir dipol oluşur.
| Kavram | Oluşma sebebi | Kalıcılık durumu | Örnek |
|---|---|---|---|
| İyon | Elektron alınıp-verilmesi | Kalıcı | Na⁺, Cl⁻ |
| Dipol (Polar) | Molekülün kalıcı yük dağılımı | Kalıcı | Su (H₂O), NH₃ |
| İndüklenmiş Dipol | Dış etkilerle geçici yük dağılımı | Geçici | İyot (I₂), Oksijen (O₂ |
Van der Waals Kuvvetleri
Dipol-Dipol Etkileşimleri
Polar moleküller, yani bir tarafı kısmen pozitif (δ⁺), diğer tarafı kısmen negatif (δ⁻) yüklü moleküller arasında oluşan etkileşimdir. Kalıcı dipolleri olan moleküller birbirlerini elektrostatik olarak çekerler.
Örnek: Örneğin hidrojen klorür (HCl) molekülünde, klor atomu negatif yüklü (δ⁻), hidrojen atomu ise pozitif yüklü (δ⁺) olur. Bir molekülün negatif kısmı, diğer molekülün pozitif kısmını çeker. Böylece dipol-dipol etkileşimi gerçekleşir.
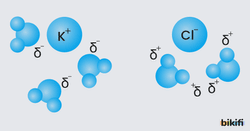
İyon-Dipol Etkileşimleri
İyonik yapılı bir madde, polar moleküllerle karşılaştığında iyon-dipol etkileşimi oluşur.
Örnek: Sofra tuzu (NaCl) suda çözünmesidir. Tuz suya atıldığında, Na⁺ ve Cl⁻ iyonları su molekülünün kutupları tarafından çekilerek çözünürler.
London Kuvvetleri (Dağılma Kuvvetleri)
London kuvvetleri, apolar moleküllerde ve soy gazlarda görülür. Bu moleküller normalde kutupsuzdur ancak elektronlar sürekli hareket ettiği için kısa süreli, geçici kutuplaşmalar (geçici dipol) ortaya çıkar. Bir molekülde oluşan bu geçici dipol, yakınındaki diğer molekülü etkileyerek indüklenmiş dipol oluşturur ve böylece London kuvveti gerçekleşir.
London kuvvetlerinin şiddeti molekülün büyüklüğü ve elektron sayısıyla artar. Molekül büyüdükçe elektron sayısı arttığından, kutuplaşma daha kolay olur ve London kuvvetleri güçlenir.
Örnek: Azot gazının sıvılaştırılması, bu tür zayıf kuvvetlerle açıklanabilir.
İyon-İndüklenmiş Dipol Etkileşimleri
İyon ile apolar molekül arasında gerçekleşir. Bir iyon, yakındaki apolar molekülün elektron dağılımını bozarak geçici kutuplar oluşturur. Bu da iyon-indüklenmiş dipol etkileşimidir.
Örnek: Sodyum iyonu (Na⁺), apolar helyum (He) atomuna yaklaştığında helyumun elektronlarını itip geçici kutuplaşmaya neden olur.
Dipol-İndüklenmiş Dipol Etkileşimleri
Polar bir molekül ile apolar bir molekülün etkileşimidir. Polar molekülün kalıcı dipolü, apolar molekülün elektron dağılımını geçici olarak etkileyip kutuplaştırır. Böylece geçici olarak oluşan zıt kutuplar birbirini çeker.
Örnek: Polar hidrojen klorür (HCl), apolar helyum (He) ile karşılaştığında, helyum atomunda kısa süreli bir kutuplaşmaya neden olur.
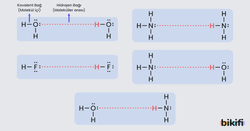
Hidrojen Bağı
Hidrojen bağı, özel bir dipol-dipol etkileşimi türüdür ancak diğer dipol-dipol etkileşimlerinden daha güçlüdür. Hidrojen atomu (H) doğrudan flor (F), oksijen (O) veya azot (N) atomlarına bağlı olduğunda, bu atomların yüksek elektronegatifliği nedeniyle molekülün içinde kuvvetli bir polarlaşma oluşur. Bu molekül diğer moleküllerdeki negatif kutuplarla güçlü bağlar oluşturur.
Örnek: Su moleküllerinin sıvı halde birbirlerine tutunmaları hidrojen bağı sayesinde gerçekleşir. Buzun sudan daha az yoğun olması da hidrojen bağlarıyla açıklanır.
Hidrojen bağı oluşturan maddeler birbiri içinde daha iyi çözünür. Bu yüzden etil alkol (C2H5OH) suda çok iyi çözünür.