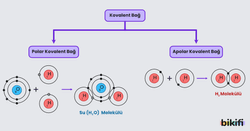
Moleküllerin özelliklerini belirleyen önemli kavramlardan biri de molekül polaritesidir. Polarite, molekülün içinde elektronların dağılımına bağlıdır. Elektron dağılımı eşitse molekül apolar, eşit değilse polar olarak tanımlanır.
Elektronegatiflik Nedir?
Elektronegatiflik, atomların bağ oluştururken elektronları çekme gücüdür. Elektronegatiflik değeri yüksek atomlar, elektronları daha güçlü bir şekilde kendine doğru çekerler. Bu özellik moleküllerin polarlık durumunu belirler.
Bazı atomların elektronegatiflik değerleri şöyledir:
- Hidrojen (H): 2,20
- Karbon (C): 2,55
- Azot (N): 3,04
- Oksijen (O): 3,44
- Flor (F): 4,00
Molekülün Şekli ve Polarite İlişkisi
Moleküllerin polar ya da apolar olmasını iki temel faktör belirler:
- Atomların elektronegatiflik farkı
- Molekülün şekli (geometrisi)
Molekül geometrisi, bağların polarite etkilerini dengeler veya güçlendirir. Örneğin, bağ polar olsa bile molekülün şekli simetrikse molekül apolar olabilir.
Polar ve Apolar Moleküller Nasıl Ayırt Edilir?
Bir molekülün polar veya apolar olduğuna karar vermek için aşağıdaki iki durumu değerlendiriyoruz:
- Polar molekül:
- Elektronegatiflik farkı nedeniyle elektronlar bir tarafa daha yakın olur.
- Kalıcı negatif ve pozitif kutuplar oluşur.
- Örneğin: Su (H₂O), hidrojen florür (HF)
- Apolar molekül:
- Molekülde elektron dağılımı simetrik ve dengelidir.
- Kalıcı kutup oluşmaz.
- Örneğin: Hidrojen gazı (H₂), oksijen gazı (O₂), azot gazı (N₂)
Dipol Moment Kavramı
Dipol moment, molekülün ne kadar polar olduğunu gösteren bir ölçüdür. Molekülün merkezi atomu çevresinde elektron dağılımı dengeli değilse dipol moment sıfırdan farklı olur ve molekül polar hale gelir.
Dipol moment sıfır ise molekül apolardır.
Günlük Hayattan Polarlık ve Apolarlık Örneği
Günlük hayatta suyun ve yağın birbirine karışmadığını gözlemlemişsinizdir. Bunun nedeni su moleküllerinin polar, yağ moleküllerinin ise apolar olmasıdır. Benzer özellikte moleküller birbirleriyle daha kolay karışırken farklı özellikteki moleküller birbirlerinden ayrılır.
Molekül Polaritesini Belirleme Adımları
Molekülün polar ya da apolar olduğunu belirlerken aşağıdaki adımları takip edin:
- Önce moleküldeki bağları değerlendirin:
- Bağ yapan atomların elektronegatiflik farkını bulun.
- Sonra molekül geometrisine bakın:
- Molekülün şekli simetrikse genelde apolardır.
- Asimetrikse polar olabilir.
Bu yöntemle farklı moleküller üzerinde çalışarak molekül polaritesini kolaylıkla belirleyebilirsiniz.