Lewis nokta yapısı, bir elementin veya bileşiğin değerlik elektronlarını (en dış katmandaki elektronlar) göstermek için kullanılan basit ama çok yararlı bir modeldir. Bu modelde, element sembolünün çevresine değerlik elektronları “nokta” şeklinde yerleştirilir. Böylece bir elementin kimyasal bağlara nasıl katılabileceği hakkında fikir sahibi olabiliriz.
Değerlik Elektronları ve Nokta Gösterimi
Değerlik elektronları, atomun en dış katmanında bulunan ve kimyasal bağ oluşumuna doğrudan katılan elektronlardır. Lewis nokta yapısını çizerken:
- Element sembolü merkezde yer alır.
- Değerlik elektronları, sembolün çevresine noktalarla yerleştirilir.
- Öncelikle her bir yöne tek nokta gelecek şekilde (örneğin, üst, alt, sağ, sol) dağıtılır.
- Eğer toplam değerlik elektron sayısı daha fazlaysa, noktalar ikili hale getirilir (çift elektron).
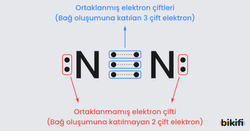
Örnek olarak N (Azot) elementinin değerlik elektron sayısı 5’tir. Lewis nokta yapısında, “N” sembolünün çevresine beş nokta yerleştirilir.
Moleküllerde Bağlar ve Eşleşen Elektronlar
İki ya da daha fazla atom bir araya geldiğinde, bağ elektronları ve yalnız (eşleşmemiş) elektron çiftleri ortaya çıkar.
- Bağ elektronları: İki atom arasında ortak kullanılan elektron çiftleridir.
- Yalnız (eşleşmemiş) elektronlar: Bağ yapmayan, atomun kendi üzerinde kalan elektron çiftleridir.
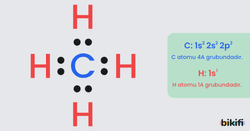
Örneğin, H2O (su) molekülünde oksijen atomu, değerlik elektronlarını hem hidrojen atomlarıyla paylaşıyor hem de kendine ait yalnız elektron çiftleri bulundurur.
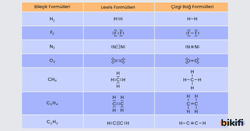
Kovalent Bağlı Bileşiklerin Lewis Formülleri
Element atomlarının son katman elektronlarının (değerlik elektronları) sayısı kadar noktayı atom simgesinin etrafına yerleştirerek oluşturulan yapılara Lewis yapıları adı verilir.
Lewis yapısının etrafındaki tek noktalara ortaklanmamış elektron; çift noktalara ise ortaklanmış elektron çifti denilmektedir. Kovalent bağ oluşurken ortaklaşa kullanılan elektron çiftine bağlayıcı elektronlar denir.
Lewis yapılarında atomlar arasındaki her elektron çifti bir kovalent bağı simgelemektedir. Bağ yapmış bu elektron çiftleri çizgiyle de gösterilebilir. Bu formüle bileşiğin çizgi bağ formülü denir. Bazı moleküllerin Lewis ve çizgi bağ formülleri aşağıda gösterilmiştir
C ile H elementleri arasında oluşacak CH4 bileşiğinin Lewis formülü yazılırken önce bileşiği oluşturan atomların elektron dizilişinden hangi grupta olduğu ve kaç bağ yapacağı bulunur. C: 1s2 2s2 2p2 C atomu 4A grubundadır yani 4 bağ yapar. H: 1s1 H atomu 1A grubundadır ve 1 bağ yapar. 1 C atomuna 4 farklı H atomu bağlanır. Fazla bağ yapan C atomu merkeze yazılır, H atomları ise C atomuna bağlanır.
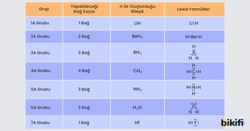
Elementlerin periyodik cetveldeki gruplara göre yapabileceği bağ sayısı ve 2. periyot elementlerinin H elementiyle oluşturduğu bileşiklerin Lewis formülleri aşağıda gösterilmiştir
Lewis Nokta Yapılarından Uzay-Geometri Modellerine
Lewis nokta yapısı, molekülün sadece iki boyutlu elektron paylaşımını gösterir. Ancak gerçekte moleküller üç boyutlu yapıdadır. Ders kitabında, Lewis nokta yapılarının ardından uzay-dolgu (veya moleküler şekil) modelleri gösterilir. Bu modeller, bağ açılarını ve molekülün gerçek şeklini anlamak için yararlıdır.
📚 Ek Bilgi: Oktet Kuralı
Atomların en dış katmanındaki elektron sayılarını 8e tamamlamasıdır.
Dublet Kuralı
Atom numarası küçük olan (Hidrojen, lityum gibi) elementlerin tek katmanındaki elektron sayılarını 2ye tamamlama durumudur.
VSEPR Modeli
Küçük moleküllü bileşiklerin geometrilerini tahmin etmek için VSEPR ( Değerlik Kabuğu Elektron Çiftleri İtme Kuramı) kullanılır. VSEPR kuramında molekül geometrisini ortaklanmış ve ortaklanmamış elektronlar belirler. VSEPR kuramının uygulanması:
- Molekülün Lewis yapısı yazılır ve merkez atomu üzerinde kaç elektron çifti (ortaklanmış ve ortaklanmamış) olduğu belirlenir.
- Elektron çiftlerinin dizilişi belirlenir.
- Atomlar yerleştirilerek molekülün biçimi sınıflandırılır.
- Ortaklanmamış elektron çiftlerinin birbirinden ve bağ yapan çiftlerden en uzakta bulunabilmeleri için molekül şekli bir miktar bozulur.
VSEPR modelinde;
- A ; merkez atomu,
- X ; merkez atoma bağlı atomları,
- E ; ise ortaklanmamış elektron çiftlerini sembolize eder.
Örnek verecek olursak BeH2‘nin VSEPR gösterimi AX2 şeklindedir.
Sigma ve Pi Bağları
Bazı moleküllerde iki atom birbirine iki ya da üç bağ ile birbirine bağlanabilir. İki atom arasındaki ilk oluşan bağ ve tekli bağların tamamı sigma(σ) bağıdır. Diğer bağlar ise pi (п) bağıdır. İki atom arasında ikili bağ varsa biri sigma diğeri pi bağıdır. Üçlü bağ varsa bir tanesi sigma diğerleri pi bağıdır.
- HCN molekülünde 2 tane sigma, 2 tane pi bağı vardır.
- C2H2 molekülünde molekülünde 3 tane sigma, 2 tane pi bağı vardır.
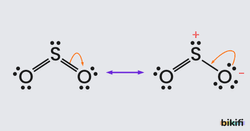
Rezonans Yapı
Çoğu zaman, bir molekül veya iyon için, tek bir elektron – nokta formülü yeterli değildir. Yani molekül veya iyon için tek bir Lewis yapısı yazılamaz. Örneğin, kükürtdioksit (SO) molekülü için;
yapıları yazılabilir. Bu Lewis formüllerinde S ve O atomlarının yerleri aynı olmakla beraber elektron çiftlerinin düzeni değişiktir. Her ikisinde de O atomlarından biri tek bağ ile diğeri çift bağ ile bağlıdır.
Diğer taraftan deneysel sonuçlar her iki S-O bağının da aynı özellikte olduğunu göstermiştir. Çünkü her iki S-O bağının da aynı uzunlukta olduğu bulunmuştur. Hâlbuki çift bağlar tek bağlardan (ve üçlü bağlar çift bağlardan) daha kısadır. O hâlde SO için çizilen yapılardan hiçbiri uygun değildir.
Fakat SO için hem oktet kuralını sağlayan ve hem de deneysel sonuçlara uyan tek bir formül verilemez. Bu durumda molekülün yapısı için olanaklı ve kabul edilebilir bütün Lewis yapıları çizilerek aralarına çift başlı oklar konur ve bu yapılara rezonans yapılar denir.
Molekül veya iyon yapılarının hem oktet kuralını sağlayan hem de deneysel sonuçlara uygun tek bir Lewis formülü ile gösterilememesi özelliği rezonans olarak bilinir. Fakat bu terim, olayı belirtmekten uzaktır, çünkü verdiği anlam SO nin yapısın (1 ve 2) yapısı arasında gidip geldiğidir. Durum ise gerçekte bu değildir, SO nin yapısı ne bir nede 2 olup ikisi arasında ve Lewis simgeleri ile kolayca doğru çizilemeyecek bir yapıdır.