Kovalent bağlarla oluşmuş maddeler, molekül olarak adlandırılan birimlerden oluşmaktadır. Moleküllerin birbirleri arasında oluşturduğu etkileşimler herhangi bir kutup (+ ve – kutupları) bulunmamasından dolayı molekül içi etkileşimler kadar kuvvetli olmaz. Bu tür moleküller arası etkileşimlere zayıf etkileşim denir ve maddenin fiziksel özelliği üzerinde kendisini gösterir. Bir maddedeki moleküller arası etkileşim kuvveti arttıkça madde oda sıcaklığında katı faza yaklaşır. Yani oda şartlarında katı ve sıvı halde bulunan 2 madde karşılaştırılırsa, katı halde bulunan maddenin molekülleri arasındaki etkileşim daha fazladır.
İyonik Bağlı Bileşiklerde Zayıf Etkileşim Yok Mu?
İyonik bileşikler, + ve – kutuplara sahip olduğu için her iyon etrafındaki zıt yüklü iyonlar tarafından çekilir ve oluşan bağ kuvvetli olur. İyonlar arası ve moleküller arası etkileşimleri şu şekilde sınıflandırabiliriz.
| Özellik | İyon-İyon | İyon-Dipol | H Bağı | Dipol-Dipol | London |
| Etkileşim Enerjisi | 500-1000 (güçlü) | 10-50 (orta) | 10-40 (orta) | 3-4 (zayıf) | 1-10 (zayıf) |
Zayıf Etkileşimler
Zayıf etkileşimler, Van der Waals kuvvetleri olarak adlandırılır ve üç temel türü; dipol-dipol bağları, london bağları ve hidrojen bağlarıdır.
Dipol – Dipol Bağları
İki atomlu bir molekülde elektronegatiflik farkından dolayı elektronların molekülün bir kısmında toplanmasıyla (kutuplanması) atomları arasında oluşan bağa polar bağ moleküle ise dipol (polar) molekül denir.
İki dipol molekül birbirlerine kutuplarının işaretine göre elektrostatik bir itme ve çekme kuvvetleri uygular. Bu etkileşimlere dipol-dipol kuvvetleri denir.

Atomlar arasındaki; elektronegatiflik farkı arttıkçadipol-dipol bağlarının kuvveti artar. Dipol-dipol kuvveti arttıkça atomlar arasındaki bağı kırmak zorlaşır ve böylece maddenin erime ve kaynama sıcaklığı daha yüksek olur. Polar (dipol) yapıya sahip moleküller birbiri içinde çözünebilir.
İyon – Dipol Etkileşimleri
Dipol maddelerin bir ucu negatif ve diğer ucu pozitif olan maddelerdir. Dipol ve iyon etkileşimini canlandırırken dipol maddeyi mıknatısa benzetebiliriz. İyonların yükü ya + ya da – olacağı için; dipol maddenin (mıknatısın) zıt yüklerini kendilerine çekerler.

Yani dipol-dipol etkileşiminde hem itme hem de çekme kuvveti bulunurken iyon-dipol etkileşiminde sadece çekme kuvveti bulunur. Bu yüzden iyon-dipol etkileşiminden oluşan bağları kırmak daha zordur.
Yemek tuzunun (NaCI) suda çözünmesi olayında tanecikler arasında oluşan etkileşim iyon – dipol bağıdır. NaCI kristalleri suya atıldığında polar su moleküllerinin negatif kutbu Na+ katyonlarına pozitif kutbu Cl– iyonlarına yaklaşır ve iyonlar kristal örgüden koparak su içerisinde dağılırlar.
London Bağları
Apolar maddeler (örneğin günlük hayatımızda adını sıkça duyduğumuz benzin), kutupsuz bağlara sahip olan kutupsuz maddelerdir. Kutupsuz bir madde olmasına karşılık benzin normal şartlarda sıvı halde bulunur (molekülleri arası etkileşim olmasaydı gaz halde bulunması gerekirdi). Apolar maddelerin molekülleri arasındaki etkileşimi Fritz W. London tarafından açıklığa kavuşmuştur ve bu etkileşimlere london etkileşimleri denir.
London etkileşimleri aslında özel durumları olan dipol-dipol etkileşimleridir. Apolar maddelerin geçici dipol maddeler gibi davranması sonucu oluşan bir etkileşimdir.
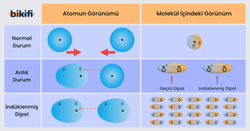
Peki Geçici Dipol Nedir?
Atomların elektronları (kutuplu veya kutupsuz olsa bile) aslında sürekli hareket halindedir. Kutuplu olan atomların bile pozitif uçlarında elektronlar bulunur. Kutupsuz (apolar) olan atomlarda elektronların hareketi sırasında anlık pozitif ve anlık negatif uçlar oluşur. Bu şekilde anlık olarak oluşan pozitif ucu, diğer (nötr) atomun ucunu kutuplandırıp kendisine çekebilir. Aynı durum anlık olarak oluşan negatif uç için de geçerlidir. Bu şekilde oluşan dipollere özel bir isim verilir: indüklenmiş dipol. Oluşan indüklenmiş dipoller birbirlerini çeker ve diğer moleküllerde de geçici dipollenmeler (kutuplanmalar) oluşturur.
London Etkileşimlerinin Özellikleri
- Anlık sürelerde gerçekleştiği için London kuvvetleri moleküller arası etkileşimlerin en zayıfı olarak kabul edilir.
- Soy gazlarda ve halojenlerde atomlar veya moleküller arasındaki tek etkileşim london bağlarıdır.
- London kuvvetleri elektron hareketliliğine bağlı olduğu için elektron sayısı arttıkça etkileşimler de artar (Atomda ne kadar çok elektron varsa o kadar çok kutuplanma ihtimali taşır).
- Dipol-dipol bağlarının oluştuğu ortamlarda da london bağlarına rastlanır. Ancak london bağı yok sayılabilecek kadar etkisiz olduğu için hesaplamaya katılmaz (bazı kovalent maddelerde london bağları ihmal edilemeyecek kadar yüksek olur. Örneğin C24H12 molekülleri arasındaki london kuvveti çok güçlüdür ve bu madde 525 °C derecede kaynar).
Hidrojen Bağları
Hidrojen bağları günlük hayatımızda çok önemli rol oynar; suyun (H2O) oda koşullarında sıvı olması hidrojen bağları sayesinde olur. Ayrıca DNA’lar birbirlerine hidrojen bağları ile bağlanır ve bu sayede hücrelerin bölünebilmesi gibi kritik yaşamsal aktiviteleri gerçekleştirebiliriz.
Hidrojen bağı; hidrojenin elektronegatifliği çok yüksek olan F, O ve N atomlarıyla oluşturduğu bileşiklerde gerçekleşir. Bu durum F, O ve N atomlarının elektronun çoğunu çekmesinden ve hidrojenin neredeyse tamamen + yüklü gibi davranması sayesinde gerçekleşir. Elektronca fakirleşen hidrojen, komşu moleküldeki elektronegatif atomun ortaklanmamış bir çift elektronunu çeker. Böylece komşu molekül ile elektrostatik etkileşime girerek bir tür köprü atom hâline gelir. Oluşan bu bağa hidrojen bağı denir.

Hidrojen Bağının Özellikleri
- Hidrojen bağı olabilmesi için molekülde kesinlikle H-O, H-N veya H-F bağları olmak zorundadır.
- Hidrojen bağı dipol-dipol ve london bağları ile kıyaslandığında, hidrojen bağları yaklaşık olarak 10 kat daha güçlüdür.
- Hidrojen bağı oluşturan maddeler birbiri içinde daha iyi çözünür. Bu yüzden etil alkol (C2H5OH) suda çok iyi çözünür.
- Bazı hidrojen bağları atomlar arasındaki kovalent bağdan daha güçlüdür. Örneğin glikoz bir kapta ısıtıldığında erimeye başlamadan önce molekül yapısı bozulur. Bu nedenle ısıtılan şeker önce karamelleşir ısıtılmaya devam edildiğinde ise kömürleşir.
- Hidrojen atomunun 1 elektronun ve 1 protonun olması, hidrojen bağının dipol-dipol bağına ek olarak elektrostatik bir kuvvetle de desteklenmesini sağlamaktadır.
- HF, H2O, NH3 bileşiklerinin kaynama noktaları, hidrojen bağları nedeni ile çok yüksektir.
- Buzun yoğunluğunun suyun yoğunluğundan az olmasının nedeni de hidrojen bağları ile açıklanmaktadır.