Kovalent bağlar, ametal atomlarının değerlik elektronlarını ortaklaşa kullanması sonucu oluşan kimyasal bağlardır. Kovalent bağ yapan atomlar arasındaki elektronegativite farkı iyonik bağdaki kadar fazla değildir. Bu yüzden bir taraf elektronunu tam vermez, diğer taraf da elektronu tam almaz; elektron ortada bir yerde kalarak ortaklaşa kullanılır. H2, O2, CO2, H2O, NH3, CH4, C2H6 gibi moleküller kovalent bağlıdır. Kovalent bağ kullanılarak oluşan bileşiklere, kovalent bağlı bileşikler denir. Kovalent bağlı moleküllerin oluşması için kullanılan elementlerin ametal olması gerekir.
Bağ Türleri
Farklı element atomları bir araya geldiğinde, elektronların paylaşım biçimine göre çeşitli bağ türleri ortaya çıkar. Temel olarak üç ana bağ türünden söz edebiliriz:
- İyonik Bağ
- Bir metal atomu, elektron kaybederek pozitif yüklü iyon (katyon) hâline gelir.
- Bir ametal atomu ise elektron kazanarak negatif yüklü iyon (anyon) oluşturur.
- Zıt yüklü bu iyonlar arasında elektrostatik çekim kuvvetiyle iyonik bağ oluşur.
- Örnek: Sodyum (Na) ve klor (Cl) arasındaki NaCl bileşiği.
- Kovalent Bağ
- İki (veya daha fazla) ametal atomu değerlik elektronlarını ortaklaşa kullanır.
- Ortak kullanılan elektronlar, bağın iki atom çekirdeği arasında yer alır.
- Bu şekilde her atom, kararlı elektron düzenine (genellikle oktet veya dublet) ulaşmaya çalışır.
- Örnek: Karbon (C) ve hidrojen (H) arasındaki bağlar; su (H₂O) molekülündeki oksijen (O) ve hidrojen (H) arasındaki bağlar.
- Metalik Bağ
- Metal atomları değerlik elektronlarını, metal atomlarının tümünün paylaştığı “elektron denizi” içinde serbestçe dolaştırır.
- Bu y�üzden metaller elektriği iyi iletir ve kolayca şekillendirilebilir.
Elektronegatiflik ve Bağın Karakteri
Elektronegatiflik, bir atomun ortaklaşa kullanılan elektronları kendine doğru çekme eğilimidir. İki atom arasındaki elektronegatiflik farkı, bağ türünün anlaşılmasında önemli bir ipucudur:
- Yüksek Fark (yaklaşık 1,7 ve üzeri): İyonik bağ oluşma eğilimi.
- Orta Fark (0,4 – 1,7 arası): Polar kovalent bağ. Elektronlar eşit olmayan şekilde paylaşılır ve kısmi (+) ve (–) yükler oluşabilir.
- Düşük Fark (0 – 0,4 arası): Apolar (non-polar) kovalent bağ. Elektronlar yaklaşık olarak eşit paylaşılır.
Günlük Hayattan Bir Örnek
- Sofra tuzu (NaCl) iyonik bağ içerir. İyonlar kristal yapı oluşturur.
- Şeker (C₁₂H₂₂O₁₁) ise karbon, hidrojen ve oksijen atomlarının kovalent bağlarıyla oluşmuş bir bileşiktir.
Apolar Kovalent Bağ
İki ametal atomu, elektronegatiflik değerleri birbirine çok yakın olduğunda (yaklaşık 0-0,4 fark) elektron çiftini eşit veya hemen hemen eşit şekilde paylaşır. Bu duruma apolar (nonpolar) kovalent bağ denir.
- Elektron Paylaşımı: Eşit veya çok yakın derecede paylaşım söz konusudur.
- Yük Dağılımı: Molekül içinde kısmi yük (δ+ veya δ–) oluşumu çok düşüktür veya hiç yoktur.
- Molekülün Özelliği: Apolar moleküller, genel olarak elektriksel anlamda nötr davranır. Çözelti içinde dipol oluşturmazlar.
- Örnek:
- Azot (N₂) ve oksijen (O₂) molekülleri de apolar kovalent bağlara örnektir.
- İki hidrojen atomu arasında oluşan H₂ bağında elektronlar eşit paylaşılır.
Polar Kovalent Bağ
İki ametal atomu arasında elektronegatiflik farkı belirli bir değerin (yaklaşık 0,4-1,7) üstünde ise elektronlar eşit olmayan biçimde paylaşılır. Bu da polar kovalent bağ adını alır.
- Elektron Paylaşımı: Bir atom elektron çiftini kendine doğru daha fazla çekme eğilimindedir.
- Kısmi Yükler (δ+ ve δ–): Daha elektronegatif atom, elektronlar üzerinde biraz daha fazla hâkimiyet kurar ve kısmen negatif (δ–) yüklenir. Diğer atom ise kısmen pozitif (δ+) olur.
- Dipol Oluşumu: Molekül içinde yük dağılımının eşit olmaması, molekülün “uçlarında” farklı yükler oluşmasına neden olur. Buna dipol adı verilir.
- Örnek:
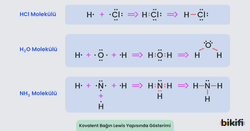
- Hidrojen klorür (HCl) molekülünde klor, hidrojenden daha elektronegatif olduğu için elektronları kendine daha çok çeker. Sonuçta H tarafı δ+ ve Cl tarafı δ– olur.
- Su (H₂O) molekülünde oksijen daha elektronegatif olduğu için kısmen negatif, hidrojenler kısmen pozitif yüklenir.
Kovalent Bağ: Elektron Paylaşımı
Kovalent bağda, ametal atomları ortak elektron çiftleri oluşturarak birbirine bağlanır. Böylece her atom, en dış katmanını (valans katmanı) kararlı bir düzene getirir. Örneğin:
- Tekli Kovalent Bağ (Tek Elektron Çifti Paylaşımı):
- Her bir hidrojen atomu 1 elektronunu paylaşarak 2 elektronlu kararlı bir düzene ulaşır (dublet).
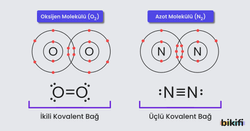
- Çift Kovalent Bağ (İki Elektron Çifti Paylaşımı):
- Örneğin oksijen (O₂) molekülünde iki elektron çifti paylaşılır.
- Üçlü Kovalent Bağ (Üç Elektron Çifti Paylaşımı):
- Örneğin azot (N₂) molekülünde üç elektron çifti paylaşılır.
Hidrojen Molekülünün (H₂) Oluşumu
Hidrojen Atomunun Özelliği
- Hidrojenin atom numarası 1’dir. Dolayısıyla elektron dizilimi 1s¹ şeklindedir.
- Hidrojen atomu, helyum gibi 2 elektronlu kararlı bir düzene (dublet) ulaşmak ister.
İki Hidrojen Atomunun Yaklaşması
- Başlangıç Durumu
- İki hidrojen atomu birbirinden uzaktır. Çekirdekler arası çekim henüz güçlü değildir.
- Her atomun birer tane değerlik elektronu vardır.
- Yaklaşma Sırasında Çekim ve İtme Kuvvetleri
- Bir hidrojen atomunun çekirdeği, diğer hidrojen atomunun elektronunu kendine doğru çekmeye başlar.
- Aynı zamanda iki pozitif çekirdek birbirini iter.
- Uygun bir mesafede çekim kuvveti, itme kuvvetine baskın gelir.
- Elektron Paylaşımı ve Kovalent Bağın Oluşumu
- Hidrojen atomları yeterince yaklaştığında, her iki atom da değerlik elektronlarını “ortak” kullanır.
- Böylece tekli kovalent bağ oluşur ve H₂ molekülü meydana gelir.
- Bu bağ sayesinde her hidrojen atomu, sanki 2 elektrona sahipmiş gibi davranarak dubletini tamamlar.
- Kararlı Molekül
- Ortak kullanılan elektron çifti, iki çekirdek arasında kalır.
- Sistemin potansiyel enerjisi en düşük hâline ulaştığında bağ uzunluğu sabitlenir.
- Bu noktada H₂ molekülü, tek başına duran hidrojen atomlarına göre daha kararlı ve düşük enerjilidir.
Formül Gösterimi
- Atomik düzeyde etkileşim:
- Moleküler formül:
Kovalent Bağın Lewis Yapısında Gösterimi
Kovalent bağların lewis yapısında gösterimi düz çizgiler şeklinde olmaktadır. Bir çizgi ortaklaşa kullanılan 2 elektronu ifade etmektedir. Aşağıdaki görselde bu durum gösterilmiştir.
Bağ Enerjisi ve Bağ Uzunluğu
Potansiyel Enerji Grafiği
İki atomun birbirine yaklaşması sırasında sistemin potansiyel enerjisi değişir. Belli bir uzaklıkta çekim ve itme kuvvetleri dengelenir:
- Çok Uzak Mesafe: Atomlar birbirine etki edemeyecek kadar uzaktadır; potansiyel enerji yüksektir çünkü bağ oluşmamıştır.
- Optimum Mesafe (Bağ Uzunluğu): Çekirdekler arası çekim kuvveti ile itme kuvveti dengelenir. Potansiyel enerji en düşük düzeydedir. Bu mesafede bağ oluşur.
- Çok Yakın Mesafe: Çekirdekler birbirini kuvvetle iter ve potansiyel enerji yeniden yükselir. Bu durum kararlı değildir.
Bağ Enerjisi
- Bağ enerjisi, oluşan kovalent bağı koparmak için gereken enerjidir.
- Bağ ne kadar güçlü ise bağ enerjisi o kadar yüksektir.
- H₂ molekülünde bağ enerjisi, hidrojen atomlarını tekrar ayrık hâle getirmek için verilmesi gereken enerjiyi ifade eder.
Günlük Hayattan Bir Benzetme: Bir mıknatısı metal yüzeye yaklaştırdığınızda, belirli bir mesafede kuvvetli bir çekim hissedersiniz. Fakat çok yaklaştığında veya uzaklaştığında, farklı kuvvet dengeleri ortaya çıkar. Atomlar da benzer şekilde bir denge mesafesinde en kararlı hâllerine ulaşırlar.