İyonik bağ, metal atomlarının elektronlarını ametal atomlarına vermesi sonucu oluşan elektrostatik çekim kuvvetine dayalı bir bağ türüdür. Bu tür bağlar genellikle periyodik tabloda solda (metaller) ve sağda (ameterller) yer alan elementler arasında gerçekleşir. İyonik bağın en temel örneği, sodyum (Na) ve klor (Cl) atomları arasında gerçekleşen sodyum klorür (NaCl) bileşiğidir.
İyonik Bağın Oluşumu ve Genel Özellikleri
İyonik bağ oluşumunu anlamak için öncelikle metal ve ametal atomlarının elektron alışverişine bakmamız gerekir:
- Metaller (örneğin sodyum, potasyum, lityum), değerlik elektronlarını kolayca kaybederek katyon (pozitif yüklü iyon) hâline gelir.
- Ametaller (örneğin klor, oksijen, kükürt) ise elektron kazanarak anyon (negatif yüklü iyon) hâline dönüşür.
- İyonik bağlarda zıt yükler birbirini çektiği için diğer güçlü bağlardan genellikle daha sağlamdır. Bundan dolayı erime – kaynama sıcaklıkları yüksektir.
- İyonik bileşiklerin katı halleri sert ve kırılgandır. İyonik katı üzerine çekiçle vurulduğunda iyonik kristalin düzenli yapısı bozulur ve kırılma olayı gerçekleşir. Fiziksel özellik bakımından seramiklere benzerler.
- İyonik bağlı katılarda iyonlar hareket etmediği için elektrik akımını iletmezler.
- İyonik katılar suda çözündüğünde elektrik akımını iletir. Örneğin tuzlu su.
Bu alışveriş sırasında elektron veren metal atomu pozitif yükle, elektron alan ametal atomu negatif yükle yüklenir. Zıt yükler birbirini çektiği için, pozitif ve negatif iyonlar arasında kuvvetli bir elektrostatik çekim oluşur. İşte bu çekim, iyonik bağın temelidir.
Sodyum ve Klor Arasındaki İyonik Bağın Oluşumu
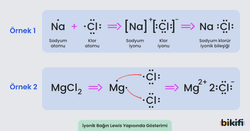
Sodyum (Na) metalinin klor (Cl) gazı ile tepkimesi sonucunda sodyum klorür (NaCl) bileşiği oluşur. Tepkime sırasında:
- Sodyum atomu elektron kaybeder:
- Sodyum, bir elektron vererek iyonuna dönüşür.
- Klor atomu elektron kazanır:
- Klor, sodyumdan gelen elektronu alarak iyonuna dönüşür.
- İyonik bağın oluşumu:
- Pozitif yüklü ve negatif yüklü iyonları arasında iyonik bağ gerçekleşir.
Bu süreçte, elektron transferi ve iyonik kristal yapının oluşması sırasında enerji değişimleri gözlenir. Elektronun sodyumdan ayrılması için belli bir iyonlaşma enerjisi gerekirken, klorun elektron kazanması elektron ilgisi ile ilişkilidir. Son aşamada ise zıt yüklü iyonların kristal örgü yapısı oluşturmasıyla büyük miktarda örgü enerjisi açığa çıkar ve toplam tepkime genellikle ekzotermik (ısı açığa çıkaran) olur.
İyonik Bağ Oluşumunu Sağlayan Etkiler
İyonik bağ oluşumunda üç temel enerji kavramı ön plana çıkar:
- İyonlaşma Enerjisi:
- Bir atomdan elektron koparmak için gerekli enerjidir.
- Metallerde bu enerji görece düşüktür, bu yüzden metaller elektron vermeye yatkındır.
- Elektron İlgisi:
- Bir atomun elektron kazanırken açığa çıkardığı veya soğurduğu enerjidir.
- Ametallerde (özellikle halojenlerde) elektron ilgisi yüksek olup, elektron kazanma eğilimleri fazladır.
- Örgü (Kristal) Enerjisi:
- Pozitif ve negatif iyonlar katı hâlde düzenli bir kristal örgü oluştururken büyük miktarda enerji açığa çıkar.
- Bu da iyonik bileşiğin oluşumunu genellikle ekzotermik hâle getirir.
İyonik Bileşiklerin Kristal Yapısı
İyonik bileşiklerde katyonlar ve anyonlar, kristal örgü adı verilen düzenli bir yapı oluştururlar. Sodyum klorürde her iyonu, çevresinde belirli sayıda iyonuyla kuşatılır ve aynı �şekilde her iyonu da belirli sayıda iyonu ile çevrilidir. Bu düzenli dizilim, bileşiğin yüksek erime ve kaynama noktalarına sahip olmasına sebep olur.
Farklı Metallerin Halojenlerle Oluşturduğu İyonik Bileşikler
Sodyum klorür (NaCl) örneği dışında, lityum (Li) ve potasyum (K) gibi diğer metaller de klorla benzer tepkimeler vererek iyonik bileşikler oluşturur:
- Lityum klorür (LiCl)
- Potasyum klorür (KCl)
Bu tepkimelerin genel prensibi, metalin elektron vererek katyona, klor atomunun ise elektron alarak anyona dönüşmesidir. Tepkime mekanizması benzese de iyonlaşma enerjisi, iyon yarıçapı ve örgü enerjisi gibi faktörler bileşiğin fiziksel özelliklerini (erime noktası, çözünürlük vb.) etkileyebilir.
Bu konuya ilişkin sorularda, metallerin farklı fiziksel ve kimyasal özelliklerinin (örneğin atom yarıçapı, iyonlaşma enerjisi) nasıl etkili olduğunu düşünmek önemlidir. Böylece benzer tipteki iyonik bileşikler arasındaki benzerlik ve farklılıkları daha iyi anlayabilirsiniz.
Çok Atomlu İyonlar (Poliatomik İyonlar)
Bazı iyonlar tek bir atomdan oluşmak yerine, birden fazla atomun kovalent bağlarla birbirine bağlı olduğu ve bu yapının toplamda yüklü olduğu durumları gösterir. Bunlara çok atomlu (poliatomik) iyonlar denir. Örnekler:
- Hidroksit:
- Sülfat:
- Karbonat:
- Nitrat:
- Fosfat:
İyonik bileşik formüllerini yazarken, katyon ve anyonun yüklerinin toplamının sıfır olması gerektiğini hatırlayın. Çok atomlu iyonlar söz konusu olduğunda, bu iyonun tamamını bir “anyon” veya “katyon” gibi düşünerek yük dengesini kurarsınız. Örneğin, magnezyum () ile nitrat ():
Bu tür sorularda öncelikle çok atomlu iyonun yükünü doğru belirleyip, metal iyonuyla en küçük ortak kat yöntemine göre formülü oluşturmak gerektiğini unutmayın.