Şu ana kadar anlattığımız bütün formüller ve hesaplamalar ideal gaz varsayımına göre yapılmaktaydı. İdeal bir gaz kinetik teoreme tam anlamıyla uyan gazlara denir, ancak gerçek hayatta kinetik teoriye uyan gaz davranışları yoktur. Bu nedenle kinetik teoriye uymayan gazlara gerçek gaz denir.
Gaz Davranışlarının İdealden Sapması
İdeal gazların, ideal olarak davranmasını sağlayan özellikleri tanecikleri arasında etkileşim olmamasıdır. Gerçek gazlarda tanecikler arası etkileşim söz konusudur. Gerçek gazların tanecikleri arasındaki etkileşimi ne kadar azaltırsak, gaz o kadar ideal davranış göstermeye başlar.
- Gerçek bir gazın sıcaklığını yükseltir ve basıncını azaltırsak (kısaca hacmini arttırırsak) ideal gaz gibi davranır.
- Gerçek gazın sıcaklığını düşürür ve basıncını arttırırsak (kısaca hacmini azaltırsak) ideal gaz davranışından sapma miktarı artar.
İdealden Sapmanın Hesaplanması
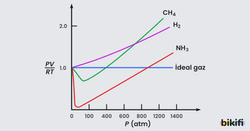
İdeal gazlar, ideal gaz denklemini tam olarak her türlü sıcaklık değerinde sağlarlar ve aşağıdaki oran her zaman 1’e eşit olur;
Ancak gerçek gazlar ısınma ve soğuma durumlarına göre bu oranı korumakta zorluk çekerler. Bu yüzden bu oran 1’e yakındır ancak 1’den küçük veya büyük olur. Bu oran 1’den ne kadar çok saparsa ideallikten sapma derecesi o kadar büyük olur.
Faz Diyagramları
Faz diyagramları, bir maddenin sıcaklık ve basınç değiştiğinde hangi fiziksel halde (katı, sıvı veya gaz) bulunacağını gösteren grafiklerdir. Günlük hayatımızdan bir örnek verecek olursak, buz pateni yapan sporcuların altındaki ince buz tabakası bir faz değişimi sonucu oluşur. Buradaki buzun, sporcu kayarken üzerine uyguladığı basınç sayesinde eridiğini görebiliriz. İşte bu durum, faz diyagramlarıyla kolayca anlaşılır hale gelir.
Faz Diyagramındaki Temel Kavramlar
Bir faz diyagramında farklı bölgeler vardır. Bu bölgeler madde hâllerini (katı, sıvı, gaz) gösterir:
- Yeşil çizgi (Erime-Donma çizgisi): Katı faz ile sıvı faz arasındaki sınırı belirtir. Bu çizginin üzerindeki sıcaklık ve basınç değerlerinde madde hem katı hem de sıvı olarak bulunabilir.
- Kırmızı çizgi (Buharlaşma-Yoğuşma çizgisi): Sıvı ile gaz fazı arasındaki sınırı gösterir. Çizgi üzerindeki değerlerde madde hem sıvı hem gaz hâlde bulunabilir.
- Mavi çizgi (Süblimleşme-Kırağılaşma çizgisi): Katı ile gaz arasındaki geçişi belirtir. Örneğin, kuru buzun (katı karbondioksit) doğrudan gaz hâline geçmesi bu duruma örnektir.
Faz Diyagramındaki Özel Noktalar
- Üçlü Nokta (T noktası): Bu noktada madde katı, sıvı ve gaz hâllerinde aynı anda bulunabilir. Bir nevi maddenin dengede olduğu özel bir noktadır.
- Kritik Nokta: Maddenin sıvı ile gaz hâli arasındaki farkın kalmadığı, özel basınç ve sıcaklık değerine sahip noktadır.
Su ve Karbondioksidin Faz Diyagramlarının Özellikleri
Günlük yaşamımızda suyun faz diyagramı çok önemlidir. Normal atmosfer basıncında (1 atm), 0°C’nin altında su katı (buz), 0°C ile 100°C arasında sıvı ve 100°C üzerinde ise gazdır (su buharı).
Karbondioksit ise ilginç bir özellik taşır. Atmosfer basıncında (1 atm), katı karbondioksit sıvı hâle geçmeden doğrudan gaz hâline dönüşür. Buna süblimleşme denir. Bu nedenle, marketlerde satılan “kuru buz” aslında katı karbondioksittir ve ortam sıcaklığında doğrudan gaz hâle dönüşür.
Gaz, Buhar ve Kritik Sıcaklık Kavramları
Bulunduğu sıcaklıkta, hiçbir koşulda sıvılaştırılamayan sıkıştırılabilir akışkanlara gaz denir. Gazların özelliğini gösteren ancak bulunduğu sıcaklıkta sıvılaştırılabilen sıkıştırılabilir akışkanlara buhar denir. Buharlar iki şekilde sıvılaştırılabilir;
- Buharlara basınç uygulanarak molekülleri arasındaki mesafenin azalması sağlanır ve bu sayede moleküller arası çekim kuvvetinin artması sağlanır. Böylece buhar sıvı hale geçer.
- Buharların sıcaklıkları düşürülerek moleküllerin kinetik enerjisinin azalması sağlanır. Kinetik enerjinin azalmasıyla birlikte gaz molekülleri bir araya gelerek kümelenmeye başlar. Böylece küçük damlalar halinde sıvılar oluşur.
Kritik Sıcaklık ve Kritik Basınç
Buhar özelliğinin bittiği ve gaz özelliğinin başladığı noktaya kritik sıcaklık denir ve Tk ile gösterilir. Kritik sıcaklıkta sıvılaştırmanın yapılabileceği en düşük basınca kritik basınç denir ve Pk ile gösterilir.
Maddeler kritik sıcaklığın üzerinde sadece gaz halinde bulunurken kritik sıcaklığın altında basıncın etkisine göre katı sıvı ya da buhar halinde bulunabilir.
| Madde | Kritik Sıcaklık (°C) | Kaynama Noktası (°C) |
|---|---|---|
| He | -267,8 | -268,6 |
| Ne | -228,6 | -245,93 |
| Ar | -122,3 | -185,7 |
| H2 | -240,01 | -252,75 |
| O2 | -118,2 | -182,82 |
| N2 | -146,8 | -195,79 |
| F2 | -129 | -188,1 |
| Cl2 | 144 | -34,6 |
| Br2 | 311 | 58,3 |
| CO2 | 31,2 | -78 |
| H2O | 374,3 | 100 |
| NH3 | 132,4 | -33,34 |
| CH4 | -82,4 | -164 |
| CCl2F2 (Freon-12) | 420 | -29,8 |
Kritik sıcaklık, maddenin moleküller arası çekim kuvveti arttıkça artar.
Gerçek Gazlarda Buharlaşma ve Yoğuşma
Gazlar sıkıştırıldığında ısınır (ideal gaz denklemini hatırlayarak neden ısındığını bulabilirsiniz), genleştirildiğinde ise soğur. Günümüzde gazların bu özelliğini buz dolaplarında, klimalarda ve soğutup ısıtma özelliğine sahip çoğu yerde kullanmaktayız. Sistemlerin verim oranı kullanılan gazın cinsine ve sistemin dış etkenlerden ne kadar iyi yalıtıldığına bağlı olarak değişiklik gösterir.
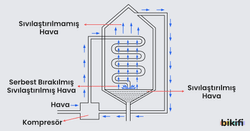
Gazların bu davranışı (sıkıştırıldığında ısınması ve genleştiğinde soğuması) Joule – Thomson olayı olarak açıklanmaktadır. Aşağıdaki görsel basit bir joule – thomson olayını görselleştirmektedir.
Soğutucu Akışkanlar
Buhar haline geçerken ortamdan ısı alarak ortamın sıcaklığını düşüren maddelere soğutucu akışkanlar denir. Joule – Thomson olayı soğutucu akışkanların kullanımı açısından çok güzel bir örnektir. Her gaz ideal bir soğutucu akışkan değildir. Soğutucu akışkan olarak kullanılabilecek şu özelliklere sahip olması gerekmektedir.
- Normal şartlar altında kaynama noktası düşük olmalı.
- Oda sıcaklığında ve basıncında gaz halinde bulunmalı
- Kritik sıcaklığı yüksek olmalı
- Kimyasal tepkimeye girme isteği az olmalı
- Yanıcı veya zehirleyici olmamalı
- Sistem maaliyetini düşürmek açısından ucuz ve kolay bulunmalı