Gazlarla ilgili daha önce 9. sınıfta bir bilgilendirme yapmıştık. Kısaca hatırlamak gerekirse;
- Gazların belirli bir hacimleri yoktur, bulundukları kabın hacmini alırlar. Bu yüzden yoğunluk (özkütle) ölçümleri maddelerin sıvı veya katı hallerindeki hacim-kütle ilişkisine göre hesaplanır.
- Özkütlesi havadan küçük olan gazlar (örneğin helyum veya hidrojen); u�çan balonlarda, zeplinlerde veya seyahat balonlarında kullanılır.
- Gaz molekülleri arasında çok fazla boşluk bulunduğu için sıkıştırılabilir.
- Gazlar ısıtıldığında katı veya sıvı haldekine göre daha çok genleşir.
- Gazların basıncı barometre olarak adlandırılan Torricelli (1608-1647) tarafından geliştirilen aletlerle ölçülür.
Daha fazla bilgi için 9. sınıftaki gazlarla ilgili içeriklere dönebilirsiniz (Gazların Tanımlayıcı Özellikleri, Gaz Yasaları ve İdeal Gaz Denklemi)
Gazların Genel Özellikleri
Hava gazlardan oluşan bir karışımdır, yaklaşık olarak hacimce %79’u azot gazı, %21’i oksijen, %0.93’ü argon ve kalan miktar diğer soygaz ve gazlardan oluşmaktadır. Gazların sıkıştırılabilmesi veya genleştirilebilmesi gaz davranışı olarak adlandırılır.
Gaz Davranışları
Gaz davranışları, sıcaklık, basınç, gaz miktarı ve gazın hacminden etkilenir. İleride bu etkileri matematiksel olarak inceleyeceğiz. İncelerken dikkat etmeniz gereken noktalar
- Mol değişiminin gaz hacmini veya basıncını doğru orantılı olarak etkiler. Yani mol sayısı 2 kat artarsa, gazın basıncı veya hacmi de 2 kat artar.
- Bilimsel çalışmalarda sıcaklık her zaman kelvin cinsinden ifade edilir. Yani sıcaklığı 30 °C (303 °K) dereceden 60 °C dereceye (333 °K) çıkarmak demek; sıcaklığı 2 kat arttırmak demek değildir.
- Gazların hacimleri bulundukları kabın hacmini aldığı için gazların hacimleri laboratuvar ortamında belirli bir sabit sıcaklık ve basınç altında gaz büretleri kullanılarak ölçülür.
- 1 mL = 1 cm3
- 1 dm3 = 1.10-3 m3 = 1L
- 1 L = 1000 cm3 = 1000 mL
- Gazların basınçları da hacime göre değişeceği için gaz basınçları sabit hacimli kaplarda ölçülür. Basınç birimi olarak atm (atmosferik basınç birimi) kullanılır.
- Basınç laboratuvar şartları dışında açık havada civa yardımıyla barometreler kullanılarak ölçülür. Civa ile yapılan ölçümler mmHg veya cmHg cinsinden ifade edilir.
- 1 atm = 76cmHg = 760 mmHg
- 1 atm = 760 torr
Gaz Basıncının Ölçülmesi
Gazlar molekülleri sürekli hareket halindedir; bu hareketten kaynaklı olarak bir basınç yaparlar. Günlük hayatımızda içinde bulunduğumuz ortama uyum sağladığımız için normal şartlarda bu basıncı hissetmeyiz. Gazların basıncını araba lastiklerinde gözlemleyebilirsiniz.
Gaz basıncı ölçerken sıvıların basınç formülünden yararlanılır (sıvılar için bu basın formülü Psıvı= h*d*g ‘dir, yani sıvının yüksekliğine sıvının yoğunluğuna ve yer çekimi ivmesine bağlıdır). Gazların basıncı ölçülürken kullanılan sıvı ne kadar yoğunsa o kadar kolay bir ölçüm yapılır. Bu yüzden hesaplama yapılırken genellikle civa kullanılır.
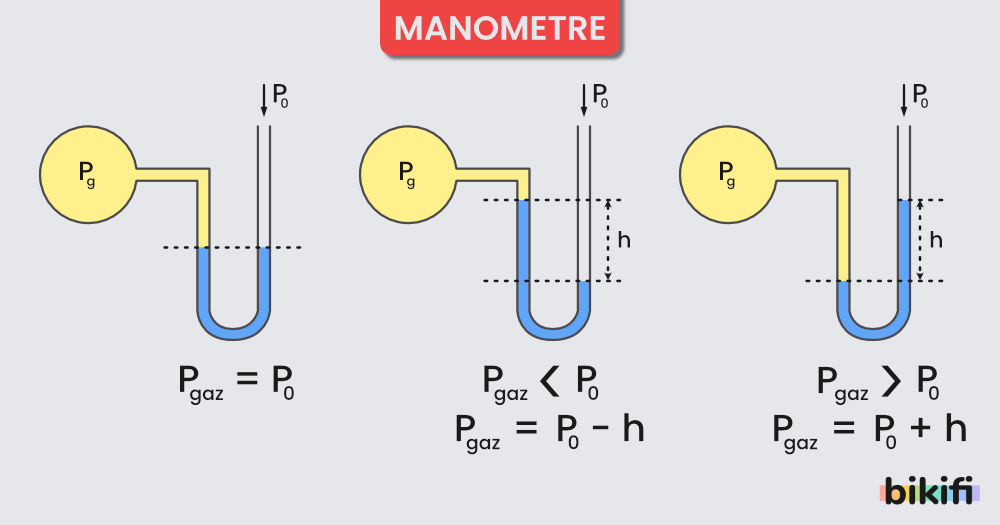
Bir gazın basıncı monametre veya barometre kullanılarak ölçülebilir. Eğer ölçüm yapılan düzeneği ve gaz dengelerini biliyorsanız. Yapmanız gereken şey, iki maddenin birbirlerine temas ettiği noktaların basınç denklemlerini yazmanızdır.
Barometre ile Gaz Basıncı Ölçümü
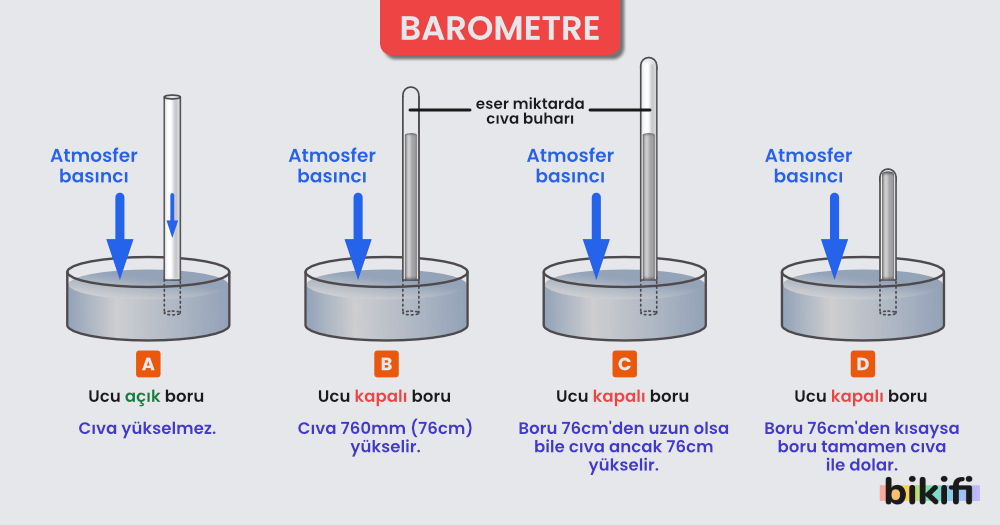
Atmosfer basıncını ölçmemize yarayan düzeneklere barometre denir. Torricelli (1608-1647) tarafından geliştirilmiştir. Barometre, basitçe tarif edilmesi gerekirse; silindirik bir tüpün içi boş kalacak (hava girmeyecek) şekilde ters çevrilerek civa dolu bir kaba daldırılmasıyla oluşur.
Barometrede temel prensip, atmosferik basıncın civayı tüpün içine doğru itmesidir. Tüpün içerisindeki civa hareketi durduktan sonra, tüpün suya temas ettiği noktadan basınçları sabitlersek; 1 atm’nin 76cm yüksekliğindeki civanın basıncına eşit olduğunu gözlemlemiş oluruz.
Yukarıdaki sayılar 0 °C sıcaklıkta ve deniz seviyesinde yapılan bir ölçüm için geçerlidir. Deniz seviyesinden yükseklere doğru çıktıkça basınç azalır, sıcaklık arttıkça basınç artar. Açık hava basıncı 1 atm = 76cmHg = 760 mmHg = 760 torr olarak adlandırılabilir.
Manometre ile Gaz Basıncı Ölçümü
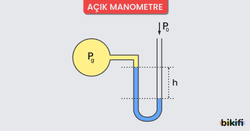
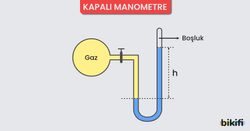
Kapalı kaplardaki gaz basıncı manometre ile ölçülür. Çalışma ilkesi bakımından barometrelerle bir benzerlik söz konusudur. Kapalı ve açık monametre olmak üzere 2 çeşidi vardır.
Manometre ile yapılmış bir ölçümü denklemlere dökerken, gazların (veya sıvıyla gazın) birbirlerine temas ettikleri noktaları kullanmaya çalışın. Örneğin;
Açık Manometre ile Gaz Basıncı Ölçümü
- Açık manometreler daha çok, açık hava basıncından büyük basınçları ölçmek için kullanılırlar.
Kapalı Manometre ile Gaz Basıncı Ölçümü
- Kapalı manometreler daha çok açık hava basıncından küçük basınçları ölçmek için kullanılırlar.