Entalpi, maddenin yapısında depoladığı her türden enerjilerin toplamıdır. H ile gösterilir. Bir maddenin entalpisinin tam değerini ölçmek mümkün değildir. Entalpi, iç enerjiye bağıml�ı bir özelliktir ve entalpi de bir hal fonksiyonu olduğundan ancak entalpi değişiminin (ΔH) belirli bir değeri vardır. Entalpi değişiminin bir çok hesaplama yöntemi bulunmaktadır.
Endotermik ve Ekzotermik Kavramları
Tepkimeler endotermik ve ekzotermik olarak ikiye ayrılır.
Endotermik Tepkimeler
Endotermik tepkimeler; bir kimyasal reaksiyonda tepkimeye giren maddelerin (standart veya molar) oluşum entalpileri toplamı, ürünlerin
(standart veya molar) oluşum entalpileri toplamından küçük olduğu durumdur. Yani endotermik tepkimelerin gerçekleşmesi için dışarıdan ısı almaları gerekmektedir. Endotermik tepkimelerin entalpisinin (ΔH) işareti “+” dır.
Buradaki + ifadesi tepkimenin başlaması için alması gereken ısıyı ifade etmek için kullanılır. Endotermik tepkimeler için dışarıdan ısı almak gerektiği için tepkimenin 1 kere gerçekleşmesinden sonra kendiliğinden devamı sağlanamaz, sınır şartları altında istemli bir tepkime değildir.
Ekzotermik Tepkimeler
Bir kimyasal reaksiyonda ürünlerin (standart veya molar) oluşum entalpileri toplamının girenlerin (standart veya molar) oluşum entalpileri toplamından küçük olduğu durumdur. Yani bu tepkimeler gerçekleşirken etrafına ısı verir. Reaksiyon entalpisinin değişim (ΔH) işareti “–” dir.
Buradaki – ifadesi tepkime bittikten sonra ortama verilen ısıyı ifade eder. Ekzotermik tepkimeler dışarıya ısı verdikleri için tepkime 1 kere gerçekleştikten sonra kendiliğinden devam edebilir. Bu yüzden sınır şartlar altında ekzotermik tepkimeler istemlidir.
Bu konuyu rahat canlandırmak için ateş yakma eylemini düşünebilirsiniz. Ortamda yeterince odun olduğunda ufak bir ateş parçasıyla tepkimeleri başlattığınız zaman diğer tepkimeler kendiliğinden gerçekleşecek ve ateş büyüyecek ve süreklilik kazanacaktır.
Standart Oluşum Entalpisi Yötemiyle Entalpi Hesabı
Bir maddenin ΔH değeri doğrudan elementlerinden sentezlenen tepkimeler üzerinden belirlenebilir.
Bir bileşiğin elementlerinden oluşması sırasındaki entalpi değişimine oluşum entalpisi (oluşum ısısı) denir ve ΔHf şeklinde gösterilir. Elementlerin ise en kararlı doğal hallerindeki standart oluşum entalpileri sıfır kabul edilir.
Bir bileşiğin 1 molünün standart şartlarda (1 atm ve 25 °C) elementlerinden oluşması sırasındaki entalpi değişimine standart molar oluşum entalpisi denir ve ΔH°f ile gösterilir.
Bir tepkimenin entalpi değişimi, ürünlerin standart oluşum entalpileri toplamından girenlerin standart oluşum entalpileri toplamı çıkarılarak bulunabilir.
Entalpi Diyagramları Yardımıyla Entalpi Hesabı
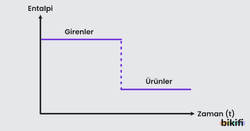
Bir tepkimenin entalpi değişimlerinin diagram üzerinde gösterilen şekline entalpi diagramı denilir. Entalpi diyagramında “Girenler” – “Ürünler” yapılarak entalpi bulunabilir. İki çeşit entalpi diyagramı karşınıza çıkabilir.
Basitleştirilmiş Entalpi Diagramları
Basitleştirilmiş entalpi diagramında sadece girenlerin ve ürünlerin entalpi değerleri bulunur. Ürünlerin entalpi değerinden girenlerin entalpi değeri çıkarıldığında entalpi değişimi bulunur. Entalpi değişimi negatif çıkıyorsa tepkime ekzotermik tepkime; entalpi değişimi pozitif çıkıyorsa tepkime endotermik tepkimedir.
Bilimsel Entalpi Diagramları
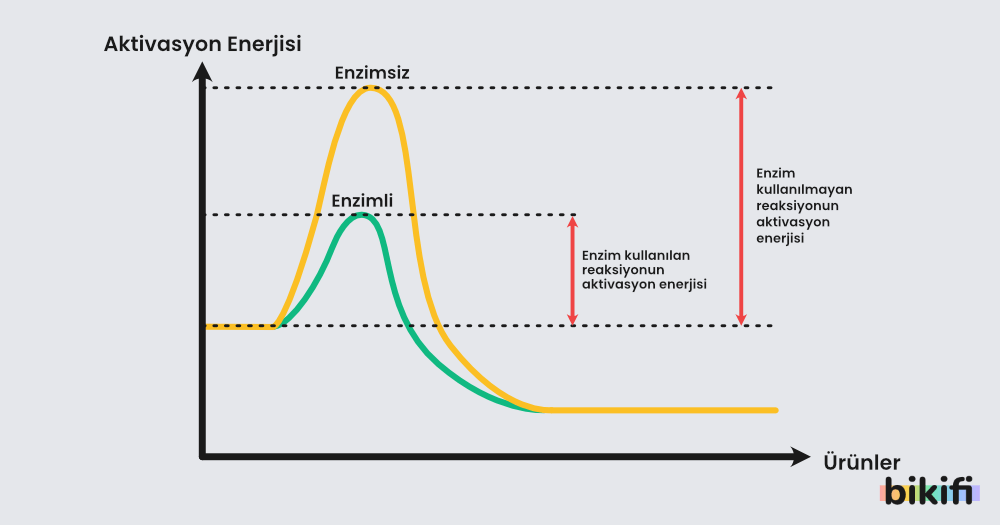
Etalpi diagramını daha detaylı incelemek istersek şu kavramlar karşımıza gelir:
- Kritik nokta: Grafiğin en tepesi kritik noktadır. Kritik noktadaki bir tepkime en kararsız noktadadır.
- İleri Aktifleşme Enerjisi: Kritik noktaya kadar kazanılması gereken enerji miktarıdır. Reaksiyonun başlaması gereken aktivasyon enerjisi olarak da isimlendirilir.
- Geri Aktifleşme Enerjisi: Kritik noktadan sonra kaybedilen enerji miktarıdır.
- Enzim: Tepkimenin aktivasyon enerjisini düşüren tepkimenin gerçekleşme süresini kısaltan kimyasal maddelerdir.
- Entalpi Değişimi: Geri Aktifleşme Enerjisi – İleri Aktifleşme Enerjisi
Bağ Enerjisi ile Tepkime Entalpisi Hesabı
Kimyasal tepkime sırasında atomlar arası bağlar kopabilir ve yenileri oluşabilir. Bağların kopması ve oluşması sırasındaki entalpi değişimleri bilinirse tepkimenin entalpisi hesaplanabilir. Bağ kırılımları endotermik, bağ oluşumları ise ekzotermiktir.
Bağ enerjisi hesaplanabilmesi için hem girenlerin hem de ürünlerin gaz halinde olması gerekmektedir. Bağ enerjisi ne kadar kuvvetliyse o bağı oluşturan atomlar arasındaki bağ o kadar kuvvetlidir. Bağ enerjisi yöntemiyle entalpi şu şekilde hesaplanır (hesaplama yapmadan önce denklemleri denkleştirin):
Hess Yasası ile Entalpi Hesabı
Bir reaksiyonun ΔH° değerinin doğrudan ölçülemediği durumlarda deneysel olarak daha önce ölçülmüş ara basamak reaksiyonlarının entalpi değişim değerlerinden faydalanılır. Tepkime ısılarının toplanabilirliğine dayanan bu yönteme Hess Yasası denir. Hess yasası uygulanırken bazı önemli kurallar bilinmelidir.
- Bir tepkime ters çevrildiğinde (girenler ürün, ürünler ise girenler şeklinde yazıldığında) tepkimeye ait entalpi değeri işaret değiştirir.
- Bir tepkime bir katsayı ile çarpıldığında tepkimeye ait entalpi değeri de aynı katsayı ile çarpılır.
- Bir tepkime, birden fazla tepkimenin toplamı şeklinde yazılabiliyorsa, toplu tepkimenin entalpi değeri, toplanan tepkimelerin entalpi değerlerinin cebirsel toplamıdır.