Atomlar arasındaki bağlar kopar ve yeniden bir başka düzende atomlar dizilir. Bu olaya kimyasal tepkime adı verilir. Kimyasal tepkimeler çok çeşitlidir. Ancak bu kısımda en önemli kimyasal tepkime çeşitlerinden bahsetmeye çalışacağız.
Kimyasal Tepkimeler
Kimyasal tepkime bir veya daha fazla maddenin yeni maddelere dönüşmesidir. Kimyasal tepkimeler kimyasal denklemlerle ifade edilir. Diğer bir deyişle kimyasal tepkime, kimyasal değişmenin meydana geldiği bir olaydır. Bir tepkime olduğunu söyleyebilmek için bazı kanıtlara gereksinim vardır.
Bu kanıtlar;
- renk değişimi,
- gaz çıkışı olması,
- berrak bir çözelti içinde çökelti oluşumu,
- iletkenlik değişimi,
- ısı salınması ya da soğurulması gibi olaylardır.
Kimyasal Tepkime Denklemlerinin Yazılması
Element ve bileşiklerin yazılması için simgeler kimyasal eşitlik adı verilen kimyasal tepkime denklemlerinin kısaca yazılmasına yardımcı olur. Bir kimyasal eşitlikte tepkenlerin (girenler) formülleri eşitliğin sol tarafına, ürünlerin formülleri ise eşitliğin sağ tarafına yazılır. Eşitliğin her iki tarafı bir ok ( ) yardımı ile birleştirilir. Bu gösterim ile tepkenlerin ürünleri oluşturduğu söylenir.
🧪 Örnek: Metan gazının (CH4) oksijen (O2) ile tepkimesini yazalım.
Tepkimedeki “+” işareti metan ile oksijenin tepkimeye girdiğini, ok işaretinin yönü() tepkimenin soldan sağa doğru gerçekleştiğini ve ok işaretinin ucunun gösterdiği taraf ürünleri belirtir.
Tepkimeye giren ve çıkan maddelerin toplamları her zaman eşit olacağından yukarıda verilen tepkime denkleminde atom sayıları eşitlenmelidir. Tepkimenin solunda 4 adet H atomu varken sağında 2 tane vardır. Bu durumda H2O nun başına 2 katsayısı yazılır.
Bu durumda tepkimenin sağında 4 O atomu varken solunda 2 vardır. O halde O2 nin başına 2 katsayısı eklenir. Oluşan eşitlik aşağıdaki gibi olur.
Bu tepkimede 1 mol metan ile 2 mol oksijenin tepkimesinden 1 mol karbon dioksit ile 2 mol su oluşmuştur denir.
Tepkimede CH4 ve O2 tepkimeye girenler (reaktifler), tepkime sonucu oluşan CO2 ve H2O ise ürün olarak adlandırılır.
| Kimyasal Tepkimelerde Korunan Özellikler | Kimyasal Tepkimelerde Değişen Özellikler | Kimyasal Tepkimelerde Değişebilen Özellikler |
|---|---|---|
| Atom sayısı ve atom türü | Kimyasal tepkimeye giren maddelerin bağları kırılır | Mol sayısı |
| Toplam kütle | Kimyasal tepkime sonucu oluşan ürünlerde yeni bağlar oluşur | Molekül Sayısı |
| Toplam proton, nötron ve elektron sayısı | Maddenin kimyasal özellikleri değişir | Basınç |
| Toplam yük | Maddenin fiziksel özellikleri değişir | Hacim |
| Çekirdeğin yapısı | Sıcaklık | |
| Fiziksel Hal |
Kimyasal Tepkime Denklemlerinin Denkleştirilmesi
Kimyasal tepkimelerde tepkimeye giren atom sayısı ve tepkimeden çıkan atom sayısı yani kütle korunur. Tepkime denklemlerinin denkleştirilmesi bu kurala göre yapılır. Tepkime denklemleri denkleştirilirken giren ve çıkanlara uygun stokiyometrik katsayılar konularak atom sayıları eşitlenir. Basit kimyasal tepkimeler sınama yöntemiyle denkleştirilir. Sınama ile denkleştirilmede, uygun stokiyometrik katsayılar giren ve ürünlere yazılır. Elementler, herhangi bir türden başlanarak denkleştirilebilir ama bu denkleştirme işi rastgele olmamalıdır. Eşitliklerin denkleştirilmesi için belirli bir yol izlenir
- Denklemin her iki tarafında yer alan bileşikte aynı element varsa önce o element denkleştirilir.
- Tepkimeye giren maddelerden ya da oluşan ürünlerden biri serbest element olarak bulunuyorsa bu element en son denkleştirilir.
- Bazı tepkimelerde, belirli atom grupları (çok atomlu iyonlar) değişmeden kalır. Bu durumda bu gruplar bir birim olarak denkleştirilir.
- Katsayılar, tam sayı ya da kesirli sayı olabilir. Bir eşitlik bir ya da daha çok kesirli katsayıyla kolayca denkleştirebilir. Bu durumda tüm katsayılar uygun bir çarpanla çarpılırsa kesirli sayılar tam sayıya dönüşür.
🧪Örnek: CaO + H3PO4 → Ca3(PO4)2 + H2O tepkimesini en küçük tamsayılarla denkleştirelim.
Tepkimede giren ve ürünlerde dört tür atom (Ca, H, O, P) bulunur. Girenlerde bir tane CaO’da bir tane Ca atomu, ürünlerde Ca3(PO4)2’de üç tane Ca atomu bulunmaktadır. Öyleyse CaO’nın katsayısı 3 olmalıdır.
3 CaO + H3PO4 → Ca3(PO4)2 + H2O
Eşitliğin girenler tarafında bir P atomu, ürünler tarafında iki P atomu bulunur. H3PO4‘ün katsayısı 2 ile çarpılırsa girenlerde de toplam iki P atomu olur.
3 CaO + 2 H3PO4 → Ca3(PO4)2 + H2O
Ca ve P’leri eşitledikten sonra girenlerde on bir O atomu, ürünlerde dokuz O atomu
bulunur. Tepkimede O’leri eşitlemek için ürünlerdeki H2O’nun önüne üç katsayısı konulur. Böylece O atomları eşitlenmiş ve tepkime de denkleşmiş olur.
Tepkimenin son hali 3 CaO + 2 H3PO4 → Ca3(PO4)2 + 3 H2O şeklinde olur.
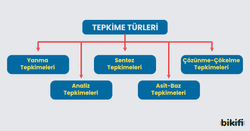
Kimyasal Tepkime Türleri
Temel tepkime türleri yanma, analiz (ayrışma), sentez (oluşum), asit-baz, çözünme-çökelme tepkimeleri şeklinde aşağıdaki gibi sınıflandırılabilir. Bu sınıflandırma tepkimelerin anlaşılmasını kolaylaştırır.
Yanma Tepkimeleri
Maddelerin, oksijenle reaksiyona girerek oksijenli bileşik oluşturmasına yanma veya oksitlenme tepkimeleri adı da verilir. O2 gazı ile reaksiyona girmeye yanma reaksiyonu denir. Bu tür tepkimelerde ürün olarak metal ya da ametallerin oksitleri oluşur. Yanma tepkimeleri sonucunda (azotun yanması hariç) ısı açığa çıkar. Yanma tepkimeleri genellikle çok hızlı gerçekleşir fakat demir metalinin yanması gibi yavaş gerçekleşen örnekleri de vardır.
Yanma Tepkimelerine verilebilecek örnekler;
- Mg + 1/2O2 → MgO (Magnezyum oksit)
- 4Na + O2 → 2Na2O (Sodyum oksit)
- Fe + 1/2O2 → FeO (Demir-2-oksit)
- 2Fe + 3/2O2 → Fe2O3 (Demir-3-oksit)
- C + 1/2O2 → CO (Karbonmonoksit)
- C + O2 → CO2 (Karbondioksit)
Organik bileşiklerin yanması: Organik bileşik, yapısında karbon ve hidrojen bulunduran bileşiktir. Organik bileşiklerin yanması sonucu karbondioksit (CO2) ve su (H2O) oluşur.
Organik bileşiklerin yanma tepkime örnekleri;
- CH + 3O 2CO + 2HO
- CH + 2O CO + 2HO
- CH + 7/2O 2Co + 3HO
- CH + 4O 3CO + 2HO
Analiz (Ayrışma) Tepkimeleri
Bir bileşiğin ısı veya elektrik enerjisiyle kendinden daha basit maddelere ayrılması tepkimesine analiz(ayrışma) tepkimeleri denir. Ayrışma tepkimeleri sonunda bir bileşikten bileşik-bileşik, bileşik-element, element-element gibi maddeler oluşabilir.
Suyun elektrolizle kendini oluşturan hidrojen ve oksijen gazlarına ayrışması analiz tepkimesine örnektir.
Sentez Tepkimeleri
İki ya da daha fazla maddenin kendi özelliklerini yitirerek yeni özellikte madde oluşturması olayına sentez ya da birleşme denir. Bu tür tepkimelere de sentez tepkimeleri adı verilir.
Sentez tepkimeleri için örnekler;
- Na + 1/2Cl NaCl
- Fe + S FeS
- N + H 2NH
- H + 1/2O HO
- H + F 2HF
- SO + HOHSO
- KO + HO 2KOH
Metal ve ametaller birleşerek tuzları veya oksitleri oluşturur.
- Ca + Cl CaCl
- 2K + 1/2O KO
Ametaller kendi arasında birleşerek moleküler bileşikler oluşturur.
- C + 2Cl CCl
- C + 1/2O CO
- P + 3H 2PH
Asit – Baz Tepkimeleri
Asit ve bazlar arasındaki tepkimelere asit-baz tepkimeleri denir
En basit hâliyle sulu çözeltilerine H+1 iyonu verebilen maddelere asit, OH-1iyonu veren maddelere de baz denir. Bu tanım Arrhenius asit-baz tanımıdır. H+1 iyonu verebilen maddeler asit olduğu gibi OH-1 iyonu alabilen maddeler de asittir. OH-1 iyonu veren maddeler baz olduğu gibi, H+1 iyonu alabilen maddeler de bazdır. Bu tanım da Bronsted-Lowry asit-baz tanımı olarak bilinir. Elektron alabilen maddeler asit, elektron verebilen maddeler de bazdır. Bu tanım da Lewis asit-baz tanımı olarak bilinir.
✍ Not: Sulu çözeltilerinde H+ iyonu oluşturabilen maddelere asit, OH¯ iyonu oluşturabilen maddelere baz denir.
Bazı Asitler
- HF: Hidroflorik asit
- HCl: Hidroklorik asit
- HBr: Hidrobromik asit
- HI: Hidroiyodik asit
- HNO: Nitrik asit
- HSO: Sülfürik asit
Bazı Bazlar
- LiOH: Lityum hidroksit
- NaOH: Sodyum hidroksit
- Mg(OH): Magnezyum hidroksit
- Ca(OH): Kalsiyum hidroksit
- NH: Amonyak
Bazı Asit – Baz Tepkimeleri
- HCl(suda)⟶H+(suda) + Cl¯(suda)
- H2SO4(suda)⟶2H+(suda) + SO42-(suda)
- CH3COOH(suda) ⇌ CH3COO–(suda) + H+(suda)
- NaOH(suda)⟶Na+(suda) + OH ¯(suda)
- KOH (suda)⟶K+(suda) + OH ¯(suda)
- Ca(OH)2(suda)⟶Ca2+(suda) + 2OH ¯(suda)
Asit ve bazların sulu çözeltilerinin tepkimeye girerek tuz ve su oluşturması olayına nötralleşme, tepkimelere de nötralleşme tepkimeleri denir. Nötralleşme tepkimeleri sonucunda genellikle ürün olarak tuz ve su oluşur. Nötralleşme tepkimeleri sonucunda ısı açığa çıkar.
HCl ile NaOH arasındaki nötralleşme tepkimesi ⟶ HCl(suda) + NaOH(suda) NaCl(suda) + H2O(s) şeklindedir.
✍ Not: Amonyak (NH3) gibi bazı bileşikler yapısında OH-1 olmadığı hâlde bazik karakterlidir. Bu tür bazların asitlerle tepkimesinden sadece tuz oluşur ve nötralleşme tepkimesi değildir fakat asit-baz tepkimesidir..
Çözünme-Çökelme Tepkimeleri
Bir maddenin başka bir madde içerisinde homojen dağılmasına çözünme denir. Suda iyi çözünen iyonik katıların sulu çözeltileri karıştırıldığında suda çözünmeyen katı oluşumuna çökelme, oluşan katıya çökelek, tepkimeye de çökelme tepkimesi denir.
İyonik maddeler suda çözündüğünde iyonlarına ayrılır. Bu iyonların birbiri ile tepkimelerinden suda çözünmeyen katı oluşur. Bu tür tepkimelere çözünme-çökelme tepkimeleri denir.
Çözünme-çökelme tepkimesi: NaCl(suda) + AgNO3 (suda) ⟶ AgCl(k)↓ + NaNO3 (suda)
Sülü çözeltide oluşan iyonlardan tepkime vermeyen iyonlara seyirci veya gözlemci iyon denir. Bu iyonlar tepkimenin her iki tarafında da bulunduğu için tepkimeden çıkarılabilir. Tepkimeye katılanlar yazıldığında tepkimenin net iyon denklemi (net iyon eşitliği) elde edilir.
Tepkime Denklemi: Na++ Cl– +Ag+ + NO3 ⟶ AgCl(k) +Na+ + NO3–
Net İyon Denklemi: Ag+ + Cl– ⟶ AgCl(k)
🧪Örnek: Gümüş nitrat (AgNO3) ile potasyum iyodürün (KI) sulu çözeltileri karıştırıldığında sarı renkli gümüş iyodür (AgI) katısı oluşuyor. Bu tepkimenin denklemini ve net iyon eşitliğini yazalım.
Tepkime Denklemi: Ag+(suda)+NO3–(suda)+ K+(suda) +I–(suda) ⟶ AgI(k) + KNO3(suda)
Net İyon Denklemi:Ag+(suda) + I–(suda) ⟶ AgI(k)
Kimyasal Tepkime Türü Nasıl Belirlenir?
Kimyasal tepkime türleri; yanma, sentez, analiz, asit-baz, çözünme-çökelme tepkimesi şeklinde sınıflandırılır. Verilen bir tepkimenin türünü anlayabilmek için aşağıda verilen durumlar aranır.
- Tepkime denkleminin girenler kısmında O2 var ise yanma tepkimesidir.
- Basit kimyasal türler daha büyük bileşikleri oluşturuyor ise sentez (oluşum) tepkimesidir.
- Büyük bileşikler küçük kimyasal türlere ayrışıyor ise analiz (ayrışma) tepkimesidir.
- Maddelerin sulu çözeltilerinin birbirleri ile verdiği tepkimede katı (çökelek) oluşuyor ise çözünme-çökelme tepkimesidir.
- Asit ve baz tepkimeye girdiğinde tuz ve su oluşuyor ise nötralleşme tepkimesidir.