✍ Elektrokimyasal hücrelerde sıkılıkla kullanılan kavramlar
- Elektrolit: Elektronlar�ın batırıldığı ve iyon hareketini sağlayarak elektriği ileten sıvılara elektrolit denir.
- Elektrot: İndirgenme ve yükseltgenme olaylarının gerçekleşmesi amacıyla çözelti içinde batırılan ve elektron akımını sağlayan metal veya grafit çubuklara elektrot denir.
- Yarı Hücre: Elektrolit ve bu elektrolit içine batırılmış elektrottan oluşan sisteme de yarı hücre denir.
- Anot Yarı Hücresi: Yükseltgenmenin gerçekleştiği kaba anot yarı hücresi denir.
- Katot Yarı Hücresi: İndirgenmenin gerçekleştiği kaba katot yarı hücresi denir.
- Anot Elektrot: Anot yarı hücresine batırılmış elektrota anot elektrot denir.
- Katot Elektrot: Katot yarı hücresine batırılmış elektrota katot elektrot denir.
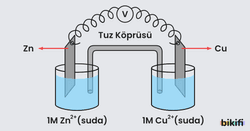
Elektrokimyasal tepkimelerde yükseltgenme ve indirgenme tepkimelerinin ikisi de gerçekleştiği için aynı zamanda bir redoks tepkimesidir. Elektrokimyasal pillerde oluşan redoks tepkimesi sonucunda yarı hücrelerde zamanla elektrot eşitsizliği meydana gelir. Bu yük denkliğinin tekrar sağlanabilmesi için yarı hücreler, içerisinde tuz çözeltisi bulunan ters U şeklindeki bir boruyla birbirine bağlanır. Bağlantıyı sağlayan bu sisteme tuz köprüsü denir. Borunun iki ucu, sıvının geçişine izin vermeyen fakat iyonların geçişine izin veren yarı geçirgen membran ya da pamuk ile kapatılmıştır.
📌 Tuz köprüsünün görevi, yarı hücreler arasındaki elektrik iletimini sağlamak ve iyonların geçmesine izin verip yarı hücrelerdeki yük dengesinin bozulmasını engellemektir.
- Kuru piller, bataryalar, yakıt pillerinde, elektrolizde ve endüstrinin birçok alanında elektrokimyadan faydalanılır.
- Elektrotlar tel, çubuk, levha vb. şeklinde olabilir. Elektrotların yapıldığı metal, içine batırıldığı sulu çözeltide bulunan metal katyonu ile aynı olabileceği gibi farklı da olabilir.
- En iyi elektrolit, kuvvetli asitlerin sulu çözeltisidir. Ancak asitlerin metalleri çabuk aşındırması sebebiyle elektrolit çözeltisi olarak genellikle iyonik bileşiklerin sulu çözeltisi kullanılır.
Yukarıdaki örnekte görülebileceği üzere Zn ve Cu elektrotları iki ayrı kapta kendi tuzlarının çözeltisine () batırılarak iki ayrı hücre oluşturulur. İki ayrı hücrenin uygun şekilde birleşimi ile hazırlanan düzeneğe elektrokimyasal hücre ad�ı verilir.
Metal Atomlarıyla Metal İyonlarının Etkileşimleri
Yukarıda anlatıldığı gibi elektrokimyasal hücrelere batırılan elektrottaki metal atomlarıyla elektrolitte bulunan metal iyonları arasında genellikle iki tür etkileşim gözlenir.
- Çözeltideki metal katyonları elektron alarak (indirgenme) elektrot yüzeyinde katı halde birikebilir.
- Elektrodun yüzeyindeki metal atomları elektron kaybederek (yükseltgenme) metal katyonu halinde çözeltiye geçebilir.
Elektrokimyasal Pil (Galvanik Hücre)
İki yarı hücrenin birbirine bağlanması ile kendiliğinden (istemli) bir elektrokimyasal tepkime meydana gelir ve bu sistemde elektrik enerjisi ortaya çıkıyorsa bu düzeneğe galvanik hücre denir. Bu hücreler, kimyasal enerjiyi elektrik enerjisine dönüştürdüğünden galvanik pil, volta pili ya da kimyasal pil denir.
Galvanik hücredeki elektronların devamlı akışı, anot ve katot arasındaki potansiyel farktan dolayı gerçekleşir. Anot, katoda oranla daha yüksek negatif potansiyel enerjiye sahip olduğu için elektronlar anottan katoda akar.
Bir galvanik hücrede elektrotlar bir metalin, kendi tuzunu içeren çözeltiye daldırılması ile hazırlanır. Pilin çalışması sırasında elektrot metali ya aşınarak çözeltiye geçer ya da elektrodun üzerine metalik birikme olur.
📌Ek Not: Bazı durumlarda, kullanılan elektrodun tepkimeye girmesi istenmez. Bu gibi durumlarda platin, altın, paladyum veya grafit (karbon) gibi maddeler elektrot olarak kullanılır. Pilin çalışması sırasında herhangi bir değişikliğe uğramayan bu elektrotlara inert elektrot denir.
Elektrokimyasal Pillerin Yarı Hücreleri Karşılaştırması
| Anot Yarı Hücresi | Katot Yarı Hücresi |
|---|---|
| Anot elektrodun işareti negatiftir. | Katot elektrodun işareti pozitiftir. |
| Yükseltgenme işlemi gerçekleşir. | İndirgenme işlemi gerçekleşir. |
| Elektrodun kütlesi tepkime süresince genellikle azalır. | Elektrodun kütlesi tepkime süresince genellikle artar. |
| Çözeltide bulunan katyon derişimi tepkime süresince artar. | Çözeltide bulunan katyon derişimi tepkime süresince azalır. |
| Pil çalışırken anot elektrolitinde pozitif yük miktarı artar. | Pil çalışırken katot elektrolitinde pozitif yük miktarı azalır. |
| Tuz köprüsündeki anyonlar anot yarı hücresine geçer. | Tuz köprüsündeki katyonlar katot yarı hücresine geçer. |
| Elektron akışı: anot => katot şeklinde gerçekleşir. | Elektrik Akışı: katot => anot şeklinde gerçekleşir. |
| Anot Yarı Hücresi | Katot Yarı Hücresi |
🚀 Ek Not: Elektrik akımının elektron akışına ters yönde hareket ettiği yaygın olarak kabul edilmektedir. Bu yüzden elektrik devlerinde bulunan pillerin yarattığı elektrik akımları da + kutuptan – kutba doğrudur.
Elektrokimyasal Pillerin Gösterilmesi
Elektrokimyasal pillerin tepkimeleri denge tepkimesidir. Bu yüzden pil tepkimesi yazılırken “⇆” denge işareti kullanılır. Elektrokimyasal piller aşağıdaki şekilde şematik olarak da gösterilebilir. Şematik gösterim için aşağıdaki kurallara uyulur.
- Sol tarafa anot, sağ tarafa katot yazılır.
- Faz sınırı “/” sembolüyle gösterilir.
- Tuz Köprüsü “//” sembolüyle gösterilir.
📝 Ek Not
Elektrolitik Hücre
Galvanik hücreler gibi elektrokimyasal hücre yapısına sahip elektrolitik hücreler de vardır. İstemsiz kimyasal tepkimenin bir dış kaynaktan sağlanan elektrik enerjisi ile gerçekleştirildiği elektrokimyasal hücrelere elektrolitik hücre denir. Elektrolitik hücrelerde tepkimenin gerçekleşmesi için istemli redoks tepkimesinde açığa çıkan enerjinin üstünde bir enerjiye ihtiyaç vardır.
Galvanik Hücre ile Elektrolitik Hücrenin Karşılaştırılması
Galvanik Hücre
- Galvanik hücrede meydana gelen tepkimeler istemlidir.
- Galvanik hücrede anot yarı hücresi, elektrolitik hücrede katot olarak adlandırılır.
- Galvanik hücrede anot negatif, katot pozitif uçtur.
- Galvanik hücrelerde elektrik enerjisi üretilir
Elektrolitik Hücre
- Elektrolitik hücrede meydana gelen tepkimeler istemsizdir.
- Galvanik hücredeki katot yarı hücresi, elektrolitik hücrede anot olarak adlandırılır.
- Elektrolitik hücrelerde ise anot pozitif, katot negatif uçtur.
- Elektrolitik hücrelerde elektrik enerjisi harcanır.
- Elektrolitik hücrelerde iki elektrot çoğunlukla aynı kapta olur ve kabın içinde sadece bir elektrolit bulunur.