Korozyon, metallerin elektrokimyasal tepkimeler sonucu metalik özelliklerini kaybetmesi olayıdır. Altın ve platin dışındaki metaller doğada genellikle bileşikler halinde bulunur. Bu bileşikler metallerin en kararlı halidir ve bu halde iken metallerin serbest enerjileri en düşük durumdadır. Mineraller, metalürjik fırınlarda enerji harcanarak metal haline dönüştürülür. Ancak metaller, üretilirken almış olduğu bu enerjiyi geri vererek doğada bulunduğu hale dönme eğilimindedir
Metalik Özelliklerin Kaybolması
Metal Cevheri (kararlı) +( enerji ) ⮕Metal (kararsız) +( enerji ) ⮕Korozyona Uğrayan Metal (kararlı)
Demir, doğada genellikle çeşitli oksit mineralleri halinde bulunur. Yüksek sıcaklıktaki fırınlarda bu minarellerden elde edilen demir metali, zamanla korozyona uğrayarak pası oluşturur. Yine bakır kapların üzerinde zamanla oluşan yeşil tabakaya da gümüş takılarda meydana gelen kararma da korozyona örnek olarak verilebilir.
Kimyasal korozyon, ıslaklık ve nemin olmadığı yüksek sıcaklıklarda meydana gelen oksitlenme tepkimeleridir. Kuru korozyon olarak da bilinen bu olay, bir gaz ortamında meydana gelir. Yüksek sıcaklıklarda demir veya çelik malzemelerin yüzeyinde oluşan pas buna örnek verilebilir. Bunun dışında meydana gelen korozyonlar ise elektrokimyasaldır. Korozyon için istenmeyen elektrokimyasal hücre de denebilir. Elektrolit olan bütün çözeltiler, doğal sular veya beton elektrokimyasal olarak korozyona neden olabilir. Rutubetli havada bulunan su buharı da metal yüzeyinde yoğunlaşarak korozyon için uygun bir elektrolitik ortam oluşturur. Bu nedenle atmosfer içinde gerçekleşen korozyon olayları da elektrokimyasal tepkimeler ile gerçekleşir. Her metali farklı biçimde etkileyen korozyon, ya metalin oksitlenmesi ve aşınması ya da parlak renginin kaybolması biçiminde görülebilir. Korozyon, birbirinden farklı iki metalin birleşim yerlerinde daha hızlı ilerleyebilir.
Korozyondan Korunma
Korozyon, kaynakların ve ürünlerin boşa harcanmasına, üretimin durmasına ve birçok kazaya neden olur. Bu nedenle metal malzemeleri korozyondan korumak amacıyla çeşitli yöntemler kullanılır. Korozyon bir yüzey olayıdır, metal ile ortamın temas yeri olan ara yüzeyde oluşur. Metalin ortamla etkileşimi çeşitli yöntemlerle kesilerek korozyon engellenmeye çalışılır. Bu yöntemlerin başında pasif bir koruma yöntemi olan boyama işlemi gelir. Metal üstündeki boya tabakası metalin ortamla olan etkileşimini keserek korozyona engel olur. Boyama işlemi ekonomik olmasına rağmen zamanla boyada meydana gelen aşınma korozyondan tam korunmayı sağlamaz. Bunun dışında çeşitli metalik, organik ve anorganik kaplama yöntemleri de kullanılır.
Elektrolitik yöntemle metalleri kaplama, korozyondan korunma yöntemlerinden biridir. Elektrolitik metal kaplama, metalik olan veya olmayan bir malzeme yüzeyine elektrokimyasal metotlarla bir film oluşturulmasıdır. Günlük yaşamda bu yöntem kullanılarak üretilmiş pek çok ürün bulunur: titanyum kaplama saatler, altın kaplama takılar, granit kaplama tavalar… Bu işlemde temel ilke, kaplama malzemesinin kaplanan metale göre ortamdan daha az etkilenmesidir. Ancak kaplama yüzeyinde oluşan çizik veya gözenekler kaplanan metalin korozyona uğramasına neden olur.
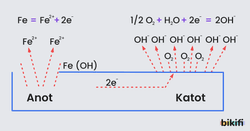
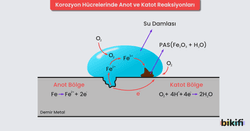
Korozyondan korunmada en etkin yöntem katodik koruma yöntemidir. Kurban elektrot yöntemi olarak da bilinen katodik koruma tekniği özellikle demir, bakır, kurşun, alüminyum gibi metallere ve bazı alaşımlara uygulanır. Metal veya alaşımlara katodik korumanın uygulanabilmesi için bu metaller sulu bir çözelti içine daldırılmış veya metallerin çevreleri ıslak maddelerle sarılmış olmalıdır. Doğal sular, içlerinde bulunan çözünmüş iyonlar nedeniyle bir elektrolit rolü üstlenir. Suyla temas eden metal yüzeyindeki bazı bölgeler anot, bazı bölgeler de katot özelliği gösterir. Böylece metal yüzeyinde mikro veya makro büyüklükte korozyon oluşabilir. Bu korozyonun nedeni, metal bileşimindeki safsızlık ya da yüzey temizleme işlemlerinden ileri gelen kabuk veya çatlaklardır. Metalden veya elektrolitten kaynaklanan bu heterojen yapı, metal yüzeyinde bir potansiyel farkının oluşmasına neden olur. Korozyon sonucu anotta çözünen metal, iyon hâlinde çözeltiye geçer. Eğer metal demir ise anot tepkimesi şu şekildedir:
Bu reaksiyon sonucu ortaya çıkan elektronlar metalin içinden akarak katot bölgesine gider. Korozyon olayının devamı için katotta bir indirgeme tepkimesi meydana gelmesi ve bu elektronların kullanılması gerekir. Katot tepkimesi işe şu şekildedir:
Anot ve katot tepkimeleri sonucu bileşiği oluşur. Ortamın asidik olması durumunda bileşiği oksijenle tepkimeye girerek bileşiğini oluşturur. Bu bileşik pas olarak adlandırılır.
Korozyon olayı bu iki tepkimenin bir arada yürümesi ile gerçekleşir. Elektronlar anottan katoda doğru metal üzerinden akar. Katot tepkimesi anottan gelen bu elektronları kullanarak yayılır. Eğer katotta bu elektronlar kullanılamaz ise bu durumda anottaki yükseltgenme tepkimesi de gerçekleşmez ve korozyon meydana gelmez. Katodik koruma yöntemi bu temele dayanır.
Bir metal ne derece aktif ise (iyon hâline geçme isteği ne derece yüksek ise) metalin korozyona uğraması da o derece kolay olur. Bu nedenle korunmak istenen metale kendisinden daha aktif bir metal bağlanacak olursa katot tepkimesi için gerekli olan tüm elektronlar bu aktif metalden gelir. Kurban elektrot olarak genellikle alüminyum, çinko ve magnezyum metalleri kullanılır. Bu durumda korunmak istenen metal yerine bu eklenen metal parçaları korozyona uğrar ve zaman içinde bu parçaları değiştirmek daha kolay olur.
Günümüzde iskele ayakları, gemiler, su ve petrol depolama tankları, kimyasal maddeleri taşıyan kaplar, ısı değiştiriciler, betonarme demirleri vb. birçok metalik yapı katodik yöntemle korunmaktadır. Özellikle yüksek basınçlı petrol ve doğal gaz boru hatlarının emniyetle işletilebilmesi ancak katodik koruma yapılarak mümkün olabilmektedir.