Elektrokimyasal pillerde istemli bir redoks tepkimesi sonucunda elektrik akımı meydana gelir ve bu tepkimelerin standart pil potansiyeli sıfırdan büyüktür. Bununla beraber istemsiz bir redoks tepkimesinin gerçekleşebilmesi için tepkimeye dışarıdan elektrik akımı uygulamak gerekir. Elektrik enerjisinin kimyasal bir değişim meydana getirmesi olayına elektroliz denir. Ancak her istemsiz redoks tepkimesi elektrikle gerçekleşmeyebilir. Elektroliz, elektrolitik hücrelerde gerçekleştirilir.
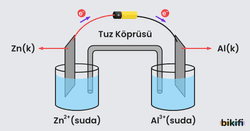
Elektrolitik hücrelerde tepkimenin gerçekleşebilmesi için hücreye istemli redoks tepkimesinde açığa çıkan potansiyelin üstünde bir potansiyel uygulamak gerekir. Örneğin galvanik hücresinde istemli bir şekilde aşağıdaki tepkime meydana gelir.
Bu tepkimenin tersi istemsizdir ve tepkimeyi meydana getirmek için 0,90 voltun üzerinde bir potansiyel gereklidir. İstemsiz tepkime denklemi şu şekildedir:
Elektrik akımı sayesinde devredeki elektron akışı ters çevrilir ve bu sayede istemsiz redoks tepkimesi meydana getirilir.
Elektrolitik hücrelerde, elektrotlar ayrı kaplarda veya aynı kapta olabilir. Bu durum elektrolitik ve galvanik hücre arasında elektrokimyasal olaylar açısından bir etkiye neden olmaz.
Elektrolizin Nicel Yorumu
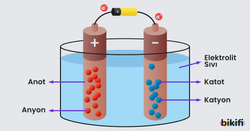
Elektroliz süresince galvanik hücrelerde olduğu gibianotta yükseltgenme, katotta indirgenmemeydana gelir. Tuz eriyikleri elektroliz edildiğinde anotta gaz çıkışı meydana gelirken katotta metal birikimi olur. Örneğin NaCl tuzu eriyiği elektroliz edildiğinde anotta iyonları gazına yükseltgenirken katotta iyonları Na katısına indirgenir.
📝UYARI:
- Elektrolizde akım kaynağı üreteçtir. Üretecin (+) kutbuna bağlı elektroda anot, eksi (-) kutbuna bağlı elektroda ise katot denir.
- Pozitif yüklü iyonlar katota gider ve indirgenirler, negatif yüklü iyonlar anoda gider ve yükseltgenirler.
Michael Faraday, bir elektrolitik hücreden akım geçmesi halinde elektrotlarda açığa çıkan madde miktarlarının elektroliz devresinden geçen akım miktarı ile doğru orantılı olduğunu bulmuştur. Bu yasaya Faraday’ın Birinci Elektroliz Yasası denir.
Elektriksel yük miktarı (Q) = Akım şiddeti (I) × zaman (t) şeklinde yazılır.
Elektriksel yükün birimi coulomb, akım şiddeti birimi amper, zaman birimi ise saniyedir. 1 mol elektron geçişi esnasında elektrik devresinden yaklaşık 96500 C (kulon) elektrik yükü geçmiş olur. Bu sayı Faraday sabiti olarak bilinir ve 1 faradaylık (F) yük şeklinde adlandırılır. Başka bir ifadeyle tane elektron 1 coulomba eşittir veya elektrolitik bir hücrenin katodunda 1,118 mg gümüşü ayıran elektrik miktarı 1 coulomb’dur.
Faraday tarafından ortaya konulan ikinci yasaya göre farklı elektrolitik hücrelerden aynı miktar elektrik akımı geçirildiğinde elektrotlarda biriken maddelerin eşdeğer kütleleri birbirine eşit olur. Eşdeğer kütle, iyon kütlesini iyonun elektriksel değerine bölerek hesaplanır.
Faraday’ın bu iki kanunu matematiksel olarak şu şekilde ifade edilir:
- m: Elektrotlarda açığa çıkan madde miktarını (gram)
- A: Atom kütlesini (gram/mol)
- n: Tesir değerliğini (alınan ya da verilen elektron sayısı)
- I: Devreden geçen akım şiddetini (amper)
- t: Akımın geçme süresini (saniye)
- 96500: Faraday sabitini (C/mol) ifade eder.
Elektroliz devresi bir elektrik devresidir. Bu nedenle elektrolitik hücre kapları birbirine seri ya da paralel bağlanabilir. Bu işlemde dikkat edilecek nokta şudur: Seri bağlanmış kapların tamamında aynı akım miktarı geçerken paralel bağlanmış kaplarda akım kollara ayrılır. Seri bağlı kaplardan geçen akım değerleri eşit ise bir kaptaki değişim yardımıyla diğer kaptaki değişim bulunabilir.
Elektrolizin Nitel Yorumu
Elektroliz olayı sayesinde bir bileşiği bileşenlerine ayrıştırmak mümkündür ve bu olay sanayide yaygın biçimde kullanılır. Alüminyum ve diğer bazı metallerin üretilmesi ve saflaştırılması, çeşitli gazların elde edilmesi, birçok organik maddenin yükseltgenmesi ve indirgenmesi işlemlerinde elektroliz kullanılır.
Suyun Elektrolizi
Saf su, oda şartlarında çok az miktarda iyonlaşabilir ve bu nedenle az miktarda elektrik iletir. Suyun iletkenliğini artırmak için elektroliz kabına bir miktar elektrolit olan sülfürik asit() katılabilir. Bu sayede elektroliz işlemi hızlanır. Su elektrolize uğradığında anotta oksijen gazı, katotta ise hidrojen gazı açığa çıkar. Elektroliz edilen suyun anot ve katot yarı tepkimeleri şu şekilde yazılır:
Anot tepkimesi :
Katot tepkimesi :
Net tepkime :
Denkleme göre anotta 0,5 mol oksijen() gazı oluşurken katotda 1mol gazı oluşmaktadır.Elektrolizin istemli olabilmesi için 1,23 V dan fazla dış gerilim uygulanması gerekir.