Kimyasal olarak denge noktasına ulaşmış bir tepkimenin denge koşullarını değiştirmediğimiz sürece sistem denge durumunu korumaya devam eder. Denge koşulları değiştiği takdirde sistem yeni oluşmuş denge şartına göre bir tepki verir. Bu tepki sistemin ileri yönlü veya geri yönlü tepkimeyi hızlandırmasıyla gerçekleşir.
Denge noktasındaki bir tepkimenin etki-tepki çalışmalarını Fransız kimyacı Henry Le Chatelier yapmıştır. Bu incelemeleri sonucunda ortaya koyduğu açıklamalara Le Chatelier Prensipleri veya İlkeleri denilmektedir. Bu ilkelere göre denge durumundaki bir tepkime;
- Sıcaklık
- Derişim
- Hacim
- Basınç
- Katalizör
Değişiminden etkilenir ve her duruma bir tepki üreterek yeni dengeyi sağlar.
| Değişikliğin Adı | Denge Durumu | Denge Sabiti |
|---|---|---|
| Sıcaklık | ✓ | ✓ |
| Derişim | ✓ | X |
| Hacim | ✓ | X |
| Basınç | ✓ | X |
| Katalizör | X | X |
Sıcaklık
Sıcaklığın değişmesi hem dengeyi hem de denge sabitini değiştirir. Sıcaklık değişimi endotermik ve ekzotermik tepkimelerde farklı sonuçlara yol açar.
İpucu: Dengedeki herhangi bir tepkime sıcaklıktaki artış durumunda tepkime denkleminde ısı bulunan tarafın tersine hareket eder. Aynı durum sıcaklıktaki azalma durumunda tepkime denkleminde ısı bulunan tarafa hareket etmesinde de gözlemlenir.
Ekzotermik Denge Tepkimelerinde Sıcaklık Değişimi
Ekzotermik (tepkime sonucunda ısı açığa çıkan) bir tepkimede;
- Sıcaklık arttırıldığında; denge, bu artış etkisini azaltmak için tepkime girenler yönüne kayar.
- Sıcaklık azaltıldığında; denge, bu soğuma etkisini azaltmak için tepkime ürünler yönüne kayar.
Denge sabiti, ileri yönlü tepkime hızı sabitinin geri yönlü tepkime hızı sabitine bölünmesiyle bulunur. Sıcaklık artışı geri yönlü tepkime hızını arttırdığı için denge sabitini azaltırken; sıcaklıktaki azalma (soğuma) ileri yönlü tepkime hızını arttırdığı için denge sabitini arttırır.
Endotermik Denge Tepkimelerinde Sıcaklık Değişimi
Endotermik (tepkimenin gerçekleşmesi için ortamdan ısı alması gereken) bir tepkimede;
- Sıcaklık arttırıldığında; denge, bu artış etkisini azaltmak için tepkime ürünler yönüne kayar.
- Sıcaklık azaltıldığında; denge, bu soğuma etkisini azaltmak için tepkime girenler yönüne kayar.
Denge sabiti, ileri yönlü tepkime hızı sabitinin geri yönlü tepkime hızı sabitine bölünmesiyle bulunur. Sıcaklık artışı ileri yönlü tepkime hızını arttırdığı için denge sabitini arttırırken; sıcaklıktaki azalma (soğuma) geri yönlü tepkime hızını azalttığı için denge sabitini azaltır.
Derişim
Denge durumunda bulunan herhangi bir sisteme madde ekleme/çıkarma yapıldığında sistem etkiyi azaltacak yöne doğru ilerler. Ancak sistem bu etkiyi azaltırken denge sabitini () değiştirmez. Bu sayede sistemin etkisini hesaplamak mümkün olur.
İpucu: Dengedeki bir tepkimeye madde eklenirse tepkime eklenen maddeyi azaltacak yönde hareket eder. Aynı şekilde dengedeki tepkimeden madde çıkarılırsa denge azalan madde miktarını artıracak yönde hareket eder.
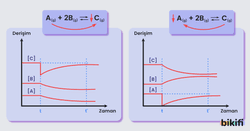
Derişim Değişikliğinin Grafik Yorumu
Denge durumundaki bir sistemde eklenen veya çıkarılan bir ürün grafikte anlık bir değişime sebebiyet verir. Daha sonra tepkime üründeki anlık değişimi azaltacak bir tepki verir ve böylece pik yapan eğri eski haline doğru çekilmeye başlar.
Hacim
Gaz halinde ürün veya girenlerin olduğu tepkimeler hacim değişikliğinden derişimleri değiştiği için etkilenirler. Sadece katı ve sıvı giren veya ürün içeren denge tepkimeleri hacim değişiminden etkilenmemektedir.
İçerisinde gaz formunda bir tepken madde bulunan tepkimeler; girenler ve ürünlerin mol sayılarının eşit olmadığı durumlarda hacim değişiminden etkilenir. Hacim değişiminden dolayı değeri değişmez.
Örnek Tepkime İncelemesi
Yukarıdaki tepkimede (, ve pozitif tam sayı olacak şekilde) ( katsayısı katı formda olduğu için dikkate alınmaz);
- ise,
- Hacim arttırıldığında, basınç azalır. Sistem azalan basıncın artması için mol sayısı yüksek olan bölüme yani girenlere kayar.
- Hacim azaltıldığında, basınç artar. Sistem artan basıncı azalması için mol sayısı düşük olan bölüme yani ürünlere kayar.
- ise,
- Hacim azaltıldığında veya arttırıldığında denge durumu değişmez; çünkü sistemin herhangi bir tarafa kayması, molekül fazlalığı yaratmaz (basıncı değiştirmez)
- ise,
- Hacim arttırıldığında, basınç azalır. Sistem azalan basıncı arttırmak için mol sayısı yüksek olan bölüme yani ürünlere kayar.
- Hacim azaltıldığında, basınç artar. Sistem artan basıncın azaltılması için mol sayısı düşük olan bölüme yani girenlere kayar.
Kısmi Basınç veya Toplam Basınç Değişimi
Gaz halinde gerçekleşen bir denge tepkimesi basınç değişiminde; meydana gelen basınç değişiminin etkisini azaltacak şekilde hareket eder. Denge sabiti kısmi basınç veya toplam basınç değişiminden etkilenmez.
Kısmi Basınç Değişimi
Kısmi basınç değişimi sisteme tepkimede bulunan herhangi bir gazdan eklemek veya çıkarmak suretiyle yapılabilir. Bu durumda sistemin dengeyi korumak için gösterdiği tepki derişim değişikliğindeki gibi bir tepki olacaktır. Yani sistem etkiyi azaltacak yöne doğru ilerler.
Toplam Basınç Değişimi
Toplam basınç değişimi “kabın hacmini değiştirmek” ve “tepkimeye girmeyen madde eklenmesi” şeklinde iki şekilde meydana gelebilir.
Kabın Hacmini Değiştirmek
Kabın hacmi değiştiğinde doğal olarak kabın basıncı da değişiklik gösterir. Hacim alt başlığında incelenen senaryo toplam basınç değişimi yöntemi için de geçerlidir.
Kaba Tepkime Vermeyen Bir Gaz Eklemek
Kaba tepkime vermeyen yeni bir madde eklemek veya var olan tepkisiz maddenin miktarını arttırmak sürtünmesiz pistonlu kaplarda hacim artışına neden olur. Hacim artışı sonucunda denge tepkimesine giren maddelerin kısmi basınçları azalır. Sistem azalma etkisini gidermek için tepkimeyi daha çok mol-gaz açığa çıkaracak tarafa kaydırır.
Katalizör
Katalizör ileri ve geri aktifleşme enerjilerini değiştirir. Böylece tepkimeler normalde daha hızlı bir şekilde denge noktasına ulaşır. Yani katalizör sadece denge noktasına ulaşma süresine etki eder. Denge durumunu veya denge sabitini değiştirmez.