Güncel

Kimyasal Denge – Denge Sabiti ve Denge Kesri
Ders Notuna git →

Tepkimenin Değişimine Göre Denge Sabitinin Değişimi
Ders Notuna git →
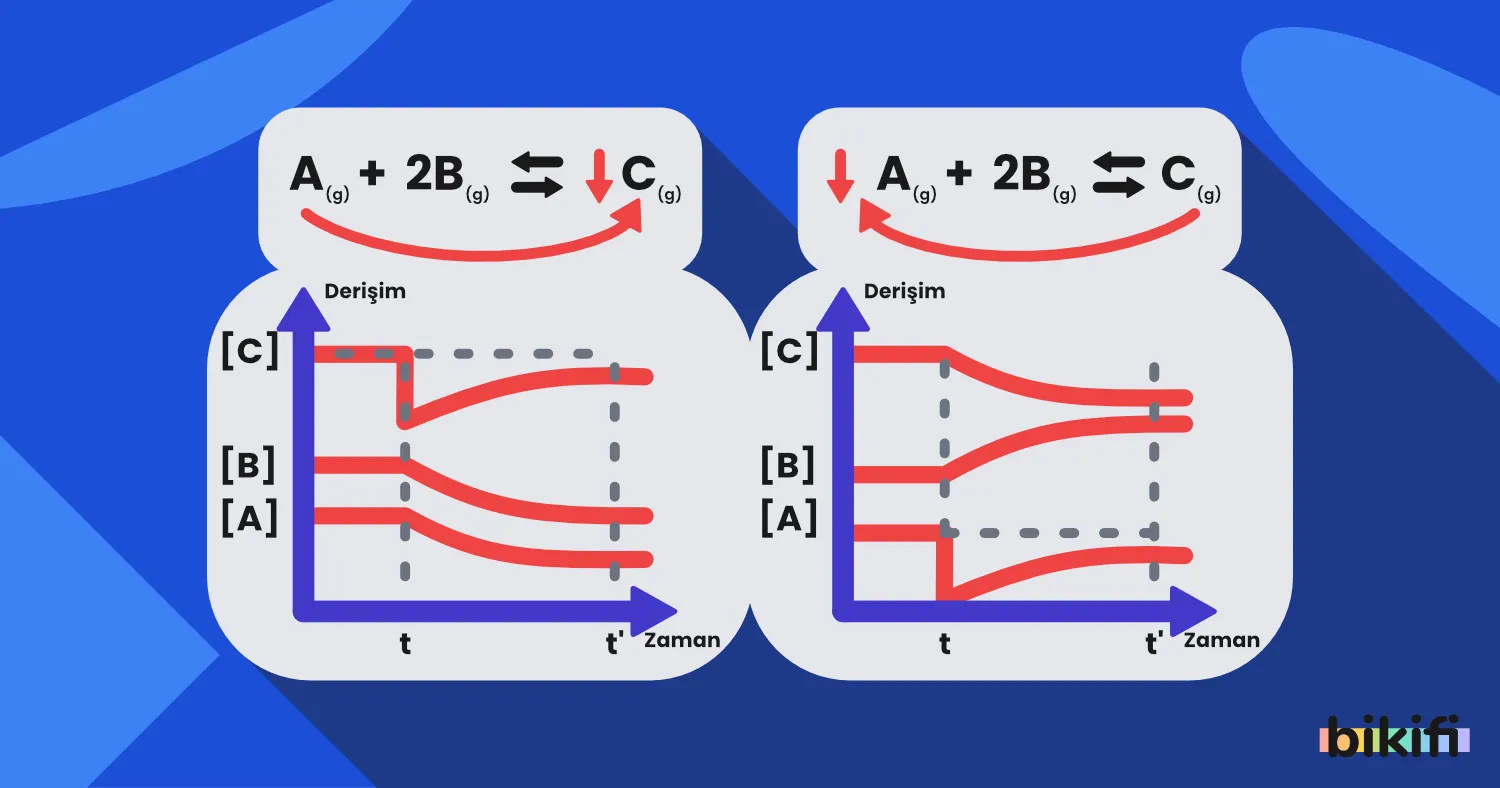
Güncel

Dengeyi Etkileyen Faktörler (Le Chatelier Prensibi)
Ders Notuna git →
Güncel

Suyun İyonlaşması ve pH Kavramı
Ders Notuna git →
Güncel

Brönsted-Lowry Asit ve Bazları
Ders Notuna git →
Güncel

Katyonların Asitliği ve Anyonların Bazlığının Su ile Etkileşimi
Ders Notuna git →
Güncel

Asit ve Bazların Ayrışma Dengesi
Ders Notuna git →
Güncel

Kuvvetli ve Zayıf Monoprotik Asit ile Baz Çözeltilerindeki pH Hesabı
Ders Notuna git →
Güncel

Tampon Çözeltilerin Özellikleri
Ders Notuna git →
Güncel

Tuzların Asit-Baz Özelliği
Ders Notuna git →
Güncel

Kuvvetli Asit-Baz Titrasyonu
Ders Notuna git →
Güncel

Çözünme-Çökelme Tepkimeleri
Ders Notuna git →
✍ PDF Çalışma Kaynakları
📘 Kurum: MEB – OGM Materyal
🔗 İndirme Linki: PDF Linki
📝 Ünite Kazanımları
- 11.6.1. Kimyasal Denge
- 11.6.1.1. Fiziksel ve kimyasal değişimlerde dengeyi açıklar.
- Maksimum düzensizlik ve minimum enerji eğilimleri üzerinden denge açıklanır.
- İleri ve geri tepkime hızları üzerinden denge açıklanır.
- Tersinir reaksiyonlar için derişim ve basınç cinsinden denge ifadeleri türetilerek hesaplamalar yapılır.
- Farklı denge sabitleri arasındaki ilişki incelenir.
- 11.6.2. Dengeyi Etkileyen Faktörler
- 11.6.2.1. Dengeyi etkileyen faktörleri açıklar.
- Sıcaklığın, derişimin, hacmin, kısmi basınçların ve toplam basıncın dengeye etkisi denge ifadesi üzerinden açıklanır.
- Le Chatelier ilkesi örnekler üzerinden irdelenir.
- Katalizör-denge ilişkisi vurgulanır.
- 11.6.3. Sulu Çözelti Dengeleri
- 11.6.3.1. pH ve pOH kavramlarını suyun oto-iyonizasyonu üzerinden açıklar.
- 11.6.3.2. Brönsted-Lowry asitlerini/bazlarını karşılaştırır.
- 11.6.3.3. Katyonların asitliğini ve anyonların bazlığını su ile etkileşimleri temelinde açıklar.
- Kuvvetli/zayıf asitler ve bazlar tanıtılır; konjuge asit-baz çiftlerine örnekler verilir.
- Asit gibi davranan katyonların ve baz gibi davranan anyonların su ile etkileşimleri üzerinde durulur.
- 11.6.3.4. Asitlik/bazlık gücü ile ayrışma denge sabitleri arasında ilişki kurar.
- Asitlerin/bazların iyonlaşma oranlarının denge sabitleriyle ilişkilendirilmesi sağlanır.
- 11.6.3.5. Kuvvetli ve zayıf monoprotik asit/baz çözeltilerinin pH değerlerini hesaplar.
- Çok derişik ve çok seyreltik asit/baz çözeltilerinin pH değerlerine girilmez.
- Zayıf asitler/bazlar için [H+] = (Ka . Ca)1/2 ve [OH–] = (Kb . Cb)1/2 eşitlikleri esas alınır.
- Poliprotik asitlere girilmez.
- 11.6.3.6. Tampon çözeltilerin özellikleri ile günlük kullanım alanlarını ilişkilendirir.
- Tampon çözeltilerin pH değerlerinin seyrelme ve asit/baz ilavesi ile fazla değişmemesi ortamdaki dengeler üzerinden açıklanır. Henderson formülü ve tampon kapasitesine girilmez.
- Tampon çözeltilerin canlı organizmalar açısından öneme değinilir.
- 11.6.3.7. Tuz çözeltilerinin asitlik/bazlık özelliklerini açıklar.
- Asidik, bazik ve nötr tuz kavramları açıklanır.
- Anyonu zayıf baz olan tuzlara örnekler verilir.
- Katyonu NH4+ veya anyonu HSO4– olan tuzların asitliği üzerinde durulur.
- Hidroliz hesaplamalarına girilmez.
- 11.6.3.8. Kuvvetli asit/baz derişimlerini titrasyon yöntemiyle belirler.
- Titrasyon deneyi yaptırılıp sonuçların grafik üzerinden gösterilerek yorumlanması sağlanır.
- Titrasyonla ilgili hesaplama örnekleri verilir.
- Öğrencilerin titrasyon yöntemiyle örnek hesaplamalar üretmeleri için elektronik tablo/program yardımıyla kurgulamalar, değerleri değiştirerek gerçekleşen değişiklikleri gözlemlemeleri ve yorumlamaları sağlanır.
- 11.6.3.9. Sulu ortamlarda çözünme-çökelme dengelerini açıklar.
- Çözünme-çökelme denge örneklerine yer verilir; çözünürlük çarpımı (Ksp) ve çözünürlük (s) kavramları ilişkilendirilir.
- Tuzların çözünürlüğüne etki eden faktörlerden, sıcaklık ve ortak iyon etkisi üzerinde durulur.
- Ortak iyon etkisi hesaplamaları yapılır.