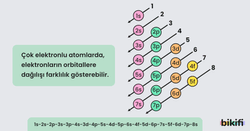
Aufbau kelimesi Almanca’da inşa etmek anlamına gelmektedir. En basit şekilde tanımlayacak olursak; elektronlar, orbitalleri en az enerjili orbitalden başlayarak doldurur. Düşük enerji seviyeli bir orbital tamamen dolmadan, bir üst seviyedeki orbitale elektron girememektedir. Çekirdeğe en yakın olan orbitalin enerjisi en azdır. Orbitallerin enerji düzeyleri küçükten büyüğe doğru s,p,d,f şeklindedir.
Aufbau kuralına göre elektronlar aşağıda verilen şekilde yerleştirilmelidir.
Aufbau ilkesi ilk 18 elementi çok iyi şekilde açıklayabilmektedir. Fakat bu 18 elementten sonra ilerlenilen her adımda elementleri açıklayabilme yetisi giderek azalmaktadır.
Aufbau İlkesinin Eksiklikleri
Çoğu kural gibi bu kuralın da istisnaları vardır. Yarı dolgulu ve tamamen doldurulmuş d ve f alt kabukları atomlara kararlılık katar, bu nedenle d ve f blok elemanları her zaman aufbau ilkesini takip etmez. Çoğu element için Aufbau yöntemine göre öngörülen elektron dağılımları deneysel olarak da doğrulanmıştır.
Birkaç elementin elektron dağılımı, bazı ufak sapmalar gösterir. Bu değişiklikler, dolu ve yarı dolu orbitallerin kararlılığı ile açıklanır (küresel simetri). Bir atom veya iyonun, eş enerjili orbitallerinden her biri tam dolu veya yarı dolu olduğunda küresel simetri özelliği gösterir. Küresel simetri özelliği gösteren atomlar diğerlerine göre daha kararlıdır.
Örneğin Cr (krom) için tahmin edilen Aufbau yapılandırması 1s2 2s22p63s23p64s23d4 olması beklenmektedir ancak gözlenen yapılandırma aslında 1s2 2s22p63s23p64s23d104p65s14d5‘tir. Çünkü d orbitalleri 10 elektrona kadar alabilmektedirler ve 4d5 küresel simetri göstermektedir.
| Atom | Öngörülen Elektron Dağılımı | Gözlemlenen Elektron Dağılımı |
|---|---|---|
| 24Cr | 1s2 2s2 2p6 3s2 3p6 4s2 3d4 | 1s2 2s2 2p6 3s2 3p64s1 3d5 |
| 29Cu | 1s2 2s2 2p6 3s2 3p6 4s2 3d9 | 1s2 2s2 2p6 3s2 3p64s1 3d10 |