Kimyasal olarak baktığımızda her tepkime farklı sürelerde gerçekleşir. Kimya biliminde tepkime hızları çok önemli ve büyük bir konudur. Kimya biliminde tepkime hızlarıyla ilgilenen dalına tepkime kinetiği denilir.
Hızın genel tanımı kimya özelinde herhangi bir değişiklik göstermez ve “birim zamanda madde miktarındaki değişime” tepkime hızı denilir. Bir kimyasal tepkimenin başlangıç anında ilk önce giren maddelerin yoğunluğu çok olduğu için tepkime hızlı başlar ancak (giren maddelerin yoğunluğu azaldığı için) yavaşlayarak devam eder.
Reaksiyon Hızı
Reaksiyon hızı r, R veya v sembolleriyle gösterilir. Birim zamandaki madde değişimi olarak tanımlanır.
şeklinde formüle edilir. Madde miktarı olarak gram, zaman olarak saniye alındığında birimi g/s olur.
Sabit hacimde gerçekleşen gaz tepkimelerinde ise hız gazların kısmi basınçlarındaki değişme göre ifade edilir. Bu durumdaki hız formülü;
şeklinde ifade edilir. Derişimin birimi mol/L ve süre olarak da 1 saniye seçildiğinde; hızın birimi mol/L.s şeklinde ifade edilir.
NOT: Hız formülleri yazılırken giren maddelerin derişimi zamanla azaldığı için önüne – (eksi), ürünlerin derişimi zamanla arttığı için önüne + (artı) işareti konulur.
Örnek
Yukarıdaki CH4‘ün yanma tepkimesinde her bir molekülün kendisine ait hız denklemlerini yazmak istersek;
- V = CH Derişimindeki Değişim / Geçen Süre = –
- V = O Derişimindeki Değişim / Geçen Süre = –
- V = CO Derişimindeki Değişim / Geçen Süre = +
- V = HO Derişimindeki Değişim / Geçen Süre = +
Birim zamanda tepkimede 1 birim CH yakmak için 2 birim oksijen harcanacağı, 1 birim CO ve 2 birim HO üretileceği için bu hızlar arasındaki ilişki şu şekilde ifade edilebilir:
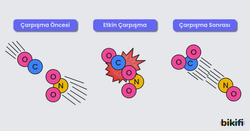
Çarpışma Teorisi
Kimyasal tepkimeleri moleküler seviyede düşündüğümüzde; ürün oluşması için giren moleküllerin (taneciklerin veya atomların) uygun açılarla çarpışması gerekmektedir. Kimyasal tepkimelerde ürünlerin, girenler arasındaki uygun çarpışmalar sonucu meydana geldiğini ortaya atan teoriye çarpışma teorisi denilmektedir. Bu teoriye göre;
- Taneciklerin çarpışması sırasında kimyasal bağlar kopar
- Atom ya da atomların yapısında bulunan elektronlar yeniden düzenlenir.
- Yeniden düzenlenen elektron yapısı sayesinde yeni kimyasal bağlar oluşur.
Etkin Çarpışma
Yukarıdaki bilgilere göre her çarpışma yapan taneciğin ürün oluşturabileceğini söyledik. Ancak anlattığımız bu teorinin işleyebilmesi için taneciklerin etkin çarpışma yapması gerekmektedir. Etkin çarpışma yapmak için; tanecikler yeterli kinetik enerjiye sahip olmalı ve bağları koparacak uygun geometrik açılarla çarpışmaları gerekmektedir.
Herhangi bir tepkime için etkin çarpışma sayısı arttıkça tepkimenin hızlandığı yorumu yapılabilir.
Not: Etkin çarpışma yapmayan tanecikler az da olsa ürün ortaya çıkarabilir, ancak ortaya çıkan ürün miktarı çok az olduğu için bu değer ihmal edilir. Örneğin çoğu tepkimede ortalama değer 1017 dir. Yani yaklaşık olarak her 1017 çarpışmadan bir tanesi sonucunda ürün oluşur.
Aktifleşme Enerjisi
Kimyasal bir tepkimede ürün oluşması için girenlerin etkin çarpışma yapmaları gerekmektedir. Bunun için de yeterli kinetik enerjiye sahip olmaları gerekmektedir. Ürünlerin yeterli kinetik enerjiye sahip olması için gereken minimum enerji miktarına aktifleşme enerjisi denir. Aktifleşme enerjisi Ea ile sembolize edilir.
Aktifleşme enerjisi fazla olan tepkimeler yavaş gerçekleşirken aktifleşme enerjisi düşük olan tepkimeler hızlı gerçekleşir. Doğal ortamda çoğu biyolojik tepkimenin hızlı gerçekleşmesi için enzim kullanılır. Aşağıdaki grafikte enzim kullanılan bir tepkimenin aktifleşme enerjisi değişimini görebilirsiniz.
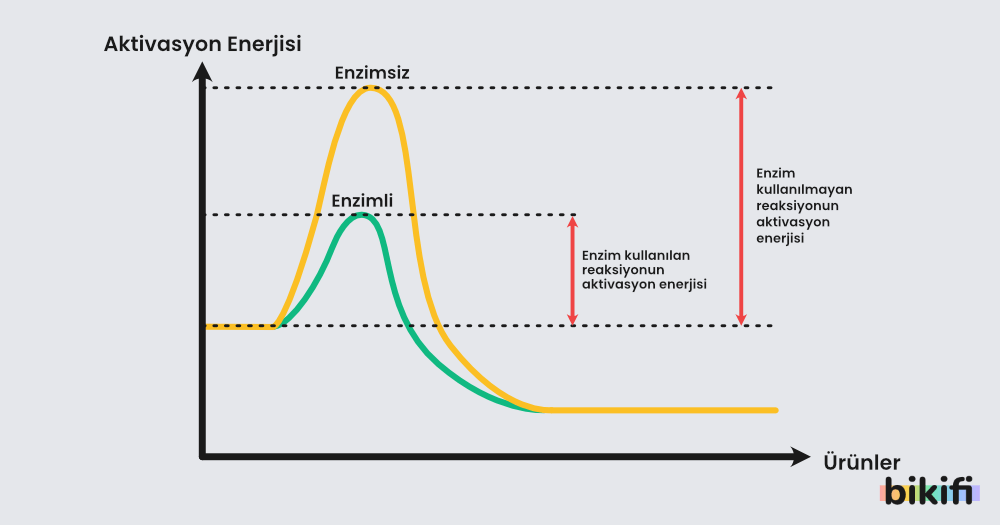
Not: Aktifleşme enerjisi sadece katalizörler sayesinde değişir. Enzim doğal bir katalizör görevi görür.
Aktifleşmiş Kompleks
Tepkimenin enerji grafiğindeki tepe noktasındaki enerji seviyesine gelen maddeye aktifleşmiş kompleks denilir. Aktifleşmiş komplekste molekülleri ayrı ayrı gözlemlemek mümkün değildir, tepkime geçiş aşamasında olarak kabul edilir.
Aktifleşmiş kompleks içerisinde bulunan tanecikler yüksek enerjili ve kararsız bir yapıdadır. Bu nedenle tanecikler potansiyel enerjilerini düşürerek kararlı hale geçmek isterler. Aktifleşmiş kompleksin içerisinde;
- Gerekli çarpışmayı ve elektron dizilimini sağlayan moleküller ürüne
- Gerekli çarpışmayı veya elektron dizilimini sağlayamayan moleküller ise tekrar eski hallerine döner.
Tepkime Grafiğinden Entalpi Hesaplanması
Etalpi diagramını daha detaylı incelemek istersek şu kavramlar karşımıza çıkar:
- Kritik nokta: Grafiğin en tepesi kritik noktadır. Kritik noktadaki bir tepkime en kararsız noktadadır.
- İleri Aktifleşme Enerjisi: Kritik noktaya kadar kazanılması gereken enerji miktarıdır. Reaksiyonun başlaması gereken aktivasyon enerjisi olarak da isimlendirilir.
- Geri Aktifleşme Enerjisi: Kritik noktadan sonra kaybedilen enerji miktarıdır.
- Enzim: Tepkimenin aktivasyon enerjisini düşüren tepkimenin gerçekleşme süresini kısaltan kimyasal maddelerdir.
- Entalpi Değişimi: Geri Aktifleşme Enerjisi – İleri Aktifleşme Enerjisi
Not: Tepkimelerin aktifleşme enerjisi büyüdükçe tepkimenin hızı azalır.
Ekzotermik ve Endotermik Tepkimeler
Ekzotermik ve endotermik tepkimelerin gerçekleşebilmesi için girenlerin çarpışarak (çarpışma teorisi) aktivasyon enerjisini aşacak yeterli enerjiye sahip olması gerekir. Yani girenler aktifleşme enerjisini aşamazsa tepkime gerçekleşmez.
Endotermik Tepkimeler
- Endotermik tepkimelerin gerçekleşmesi için dışarıdan ısı almaları gerekmektedir. Endotermik tepkimelerin entalpisinin (ΔH) işareti “+” dır
- Buradaki “+” ifadesi tepkimenin başlaması için alması gereken ısıyı ifade etmek için kullanılır.
- Endotermik tepkimeler için dışarıdan ısı almak gerektiği için tepkimenin 1 kere gerçekleşmesinden sonra kendiliğinden devamı sağlanamaz, sınır şartları altında istemli bir tepkime değildir.
- Endotermik tepkimelerde, girenlerin potansiyel enerjileri toplamı ürünlerin potansiyel enerjileri toplamından düşüktür. Girenler düşük sıcaklıkta, ürünler iste yüksek sıcaklıkta daha kararlıdır.
Ekzotermik Tepkimeler
- Bu tepkimeler gerçekleşirken etrafına ısı verir. Reaksiyon entalpisinin değişim (ΔH) işareti “–” dir.
- Buradaki “–” ifadesi tepkime bittikten sonra ortama verilen ısıyı ifade eder.
- Ekzotermik tepkimeler dışarıya ısı verdikleri için tepkime 1 kere gerçekleştikten sonra kendiliğinden devam edebilir. Bu yüzden sınır şartlar altında ekzotermik tepkimeler istemlidir.
- Ekzotermik tepkimelerde, ürünlerin potansiyel enerjileri toplamı girenlerin potansiyel enerjileri toplamından düşüktür. Ürünler düşük sıcaklıkta, girenler ise yüksek sıcaklıkta daha kararlıdır.