Reaktiflik, bir maddenin reaksiyona girme eğilimi olarak tanımlanır. Güçlü etkileşimler meydana gelirken atomların en dışarıda bulunan elektronları etkileşir. En dış katmanda bulunan bu elektronlara değerlik elektron denir. Örneğin oksijen (6A) elementinin değerlik elektron sayısı 6’dır.
Formül: Bir atomda her katmanda bulunabilecek en fazla elektron sayısı “2n2” ile hesaplanır. Formüldeki n harfi katman sayısını temsil eder.
Bilgi: Herhangi bir atom; proton sayısı ile elektron sayısı eşit olursa nötr atom, proton sayısı elektron sayısından fazla ise katyon, proton sayısı elektron sayısından az ise anyon olarak adlandırılır.
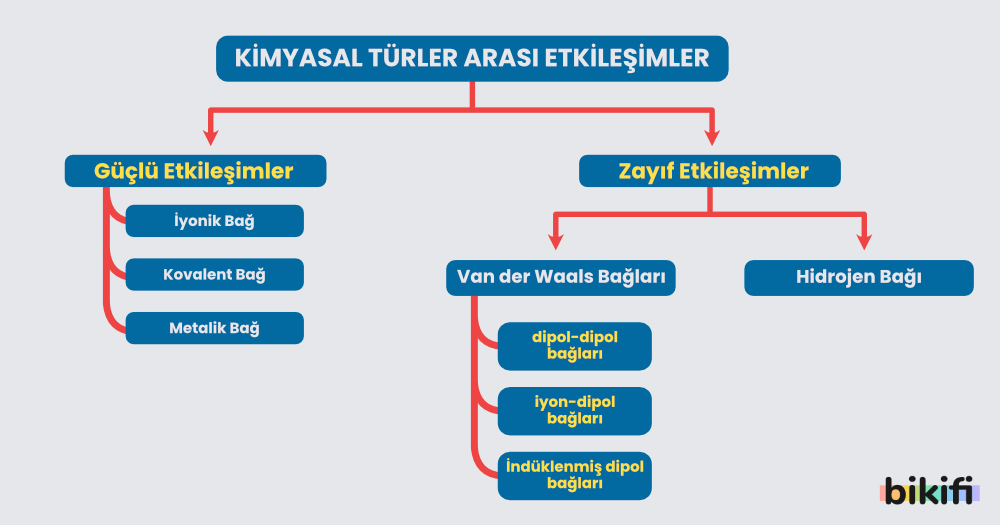
Güçlü etkileşimler yukarıda da gösterildiği gibi iyonik bağ, kovalent bağ ve metalik bağ olmak üzere üçe ayrılırlar.
İyonik Bağ (Metal – Ametal)
Elektron alışverişi gerçekleştirerek oluşan bağlara iyonik bağ denir. İyonik bağın oluşmasını, atomların elektron çekme isteğinin (elektronegativite) farklı olması sağlar. Elektron çekme isteği daha fazla olan atomun elektron sayısı proton sayısını geçer ve böylece bileşiğin anyon kısmını, elektron veren kısım ise bileşiğin katyon kısmını oluşturur. Örneğin günlük hayatta sıklıkla kullandığımız sofra tuzu (NaCl) bileşiği iyonik bir bileşiktir ve bileşikte sodyum (Na) katyon (Na+), klor (Cl) anyondur (Cl–).
İyonik Bağın Sağlamlığı
İyonik bağın sağlamlığını veya iki iyonik bağ arasında hangisinin daha sağlam olduğunu bileşiği oluşturan atomların yarı çaplarına ve zıt yüklerin sayısına bakarak karar veririz. Bu değişkenlerin iyonik bağa etkisi şu şekildedir;
- İyon yarıçapı arttıkça, iyonik bağın gücü azalır.
- İyon yükü arttıkça çekim gücü artar ve iyonik bağın kuvveti artar.
Atom yarıçapına ve alacakları yüklere periyodik özellikler konusunda bulabilirsiniz.
İyonik Bağın Özellikleri
- İyonik bağlarda zıt yükler birbirini çektiği için diğer güçlü bağlardan genellikle daha sağlamdır. Bundan dolayı erime – kaynama sıcaklıkları yüksektir.
- İyonik bağda bulunan metaller katyonları, ametaller anyonları oluşturur.
- İyonik bileşiklerin katı halleri sert ve kırılgandır. İyonik katı üzerine çekiçle vurulduğunda iyonik kristalin düzenli yapısı bozulur ve kırılma olayı gerçekleşir. Fiziksel özellik bakımından seramiklere benzerler.
- İyonik bağlı katılarda iyonlar hareket etmediği için elektrik akımını iletmezler.
- İyonik katılar suda çözündüğünde elektrik akımını iletir. Örneğin tuzlu su.
İyonik Bağın Lewis Yapısında Gösterimi
Lewis yapısı, iyonik bileşiklerin oluşumu “elektron nokta” formülü ile gösterilebilir. Değerlik elektronlar (atomun son yörüngesinde bulunan elektron sayısı) elementin sembolü etrafında noktalar ile gösterilir. Yukarıdaki örnekte NaCl’nin oluşumu lewis yapısında gösterilmiştir.

Kovalent Bağ (Ametal – Ametal)
Elektron ortaklaşması sonucu kurulan bağlara kovalent bağ denir. Kovalent bağ yapan atomlar arasındaki elektronegativite farkı iyonik bağdaki kadar fazla değildir. Bu yüzden bir taraf elektronunu tam vermez, diğer taraf da elektronu tam almaz; elektron ortada bir yerde kalarak ortaklaşa kullanılır. H2, O2, CO2, H2O, NH3, CH4, C2H6 gibi moleküller kovalent bağlıdır. Kovalent bağ kullanılarak oluşan bileşiklere, kovalent bağlı bileşikler denir. Kovalent bağlı moleküllerin oluşması için kullanılan elementlerin ametal olması gerekir.
Kovalent Bağın Lewis Yapısında Gösterimi
Kovalent bağların lewis yapısında gösterimi düz çizgiler şeklinde olmaktadır. Bir çizgi ortaklaşa kullanılan 2 elektronu ifade etmektedir. Aşağıdaki görselde bu durum gösterilmiştir.

Bazı durumlarda atomlar oktetlerini tamamlamak için diğer atomlarla birden fazla bağ yapabilirler. Bu tip bağlara ikili kovalent bağ denir ve lewis yapısında şu şekilde gösterilir. Bazı durumlarda atomlara ikili kovalent bağ yapmak da yetmez. Böyle durumlarda üçlü kovalent bağ yapılabilir. N molekülü üçlü kovalent bağa, O molekülü de ikili kovalent bağa örnektir.

Apolar ve Polar Kavramları

Kovalent bağ, apolar ve polar kovalent bağ olmak üzere ikiye ayırılır.
Apolar Kovalent Bağ (Kutupsuz Kovalent Bağ): Bağı yapan atomların elektronegatiflikleri eşitse meydana gelen bağ çeşididir. Yani iki atomda elektronu aynı şiddetle çeker ve elektron üzerinde kutupsuz bir çekim meydana gelir. Aynı cins iki ametal atomunun birleşmesiyle meydana gelir. Apolar kovalent bağ örnekleri; iki oksijen atomunun elektronlarını ortaklaşa kullanarak meydana getirdikleri bağıdır.
Polar Kovalent Bağ (Kutuplu Kovalent Bağ): İki farklı cins atomun bir araya gelmesiyle oluşur. Farklı atomlar oldukları için oluşan elektronegativite farkı, atomlardan elektronegativitesi yüksek olanın kısmi negatif, diğerinin ise kısmi pozitif yüklenmesini sağlar. Örneğin suyu meydana getiren hidrojen ve oksijen moleküllerinin son orbitallerindeki elektronların ortak kullanılmasıyla polar kovalent bağ meydana gelir.
Kimyasal Bağların Kovalent ve İyonik Karakterleri
Bir bağın iyonik veya kovalent bağ olması, bağın gösterdiği kovalent veya iyonik karaktere bağlıdır. İyonik ve kovalent karakterleri birbirinden ayıran en büyük etken bağı yapan atomlar arasındaki elektron çekme isteği farkıdır. Bu fark büyükse iyonik karakter, düşükse kovalent karakter ağır basmaktadır.
İyonik bağın tamamen iyonik bağ olması için (%100 iyonik karakterde) bağdaki bir atomun diğerinin bütün elektronlarını sahiplenmesi gerekmektedir. Ancak bir kimyasal bağdaki elektronlar %100 bağdaki bir atoma ait olamaz. Çünkü bu elektronlar her iki atom tarafından az ya da çok çekilir. Dolayısıyla bir kimyasal bağ ne kadar iyonik olursa olsun mutlaka kovalent karakter taşır. Yani %100 iyonik karakterdeki bir bağ mümkün değildir.
İki atom arasındaki elektronegatiflik farkı sıfırsa oluşan bağ %100 kovalent karakterdedir. Bu duruma aynı atomlar arasındaki bağlarda gözlemlenir. Örneğin; O2 ve N2 molekülleri.
Metalik Bağ
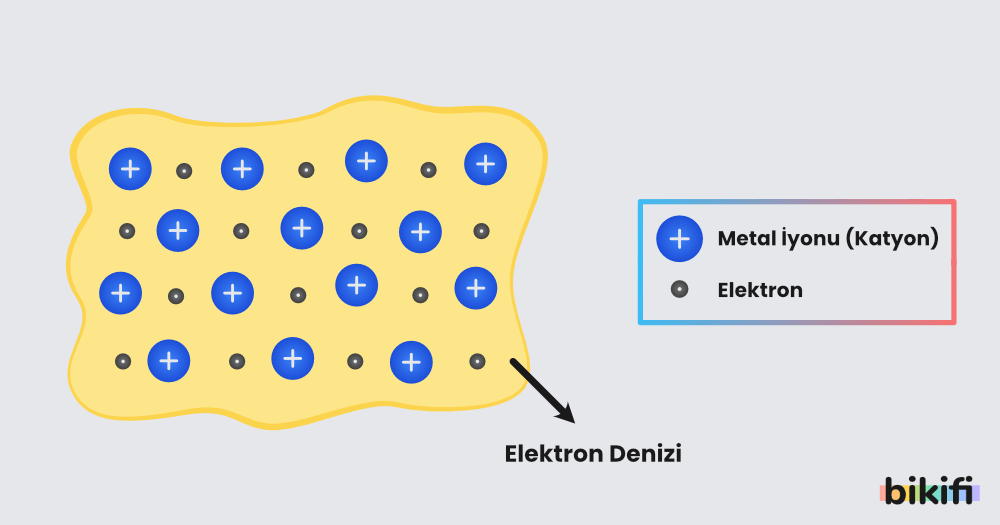
Metal atomlarını bir arada tutan bağa metalik bağ denir. Metaller katı halde kristal örgüler oluşturur. Bu örgüler iyonik bileşiklerin örgülerine çok benzerlik gösterir. Katı haldeki metal örgülerinde her metal atomunun yanında 8-12 arasında diğer metal atomları bulunur.
Metal atomlarının değerlik elektronları bu kristal yapıda diğer atomların değerlik elektronlarına göre daha serbesttir ve daha fazla hareket edebilir. Değerlik elektronları kristal yapıda elektron denizi oluşturur. Kristal yapıdaki metal atomları da değerlik elektronlarını kaybettikleri için katyon gibi olur.
Bu şekilde elektron denizinin katyonlar tarafından çekilmesiyle oluşan bağa metalik bağ denir.
Metalik Bağın Özellikleri
- Metallerin yapısında bir elektron denizi bulunduğu için dışarıdan bir darbe uygulandığında şekil vermek mümkündür.
- Serbest hareket edebilen elektronlar olduğu için metaller elektrik akımını iletir.
- Metaller elektrik iletkenliği açısından kıyaslandığında iyonik ve kovalent bağlı bileşiklere göre oldukça yüksek iletkenliğe sahiptirler.
- Metallere parlaklık sağlar.
- Metalik bağ, metalleri sertleştirir, erime ve kaynama noktasını arttırır.
- Bir grupta aşağı doğru indikçe çap büyüdüğünden metal bağı zayıflar, erime noktası düşer.
- Bir periyotta sağa doğru gittikçe, çap küçüldüğünden metal bağının kuvveti artar, erime noktası yükselir.
- Metalin değerlik elektron sayısı arttıkça, oluşan metalik bağ daha da kuvvetlenir.
Ek konu anlatımı:Kovalent ve İyonik Bileşiklerin Adlandırılması













