Maddeler üzerine uygulanan ısı, yalnızca sıcaklıklarını yükseltmekle kalmaz; belirli koşullar altında hâl değişimi adı verilen katı-sıvı-gaz geçişlerini de tetikleyebilir. Hâl değişimi sıcaklığı, saf maddeler için ayırt edici bir özelliktir. Maddenin erime, donma, kaynama ya da yoğunlaşma gibi süreçleri bu sabit sıcaklıkta gerçekleşir.
Katının sıvı hale geçmesine erime, sıvıdan katı hale geçişe donma denir. Sıvının gaz hale geçmesine buharlaşma, gazın sıvı hale geçişine yoğunlaşma denir. Sıvının her sıcaklığında buharlaşma gerçekleşmektedir fakat sıcaklık artışı buharlaşmayı artırır, gözle görülebilir duruma ise kaynama denir.
Hal Değişim Sıcaklığını Etkileyen Faktörler
Maddenin Saflığı ve Hâl Değişimi Sıcaklığı
Bir maddenin saflığı erime ve kaynama sıcaklıklarını doğrudan etkiler. Saf maddeye farklı maddeler eklendiğinde, karışımın erime ve kaynama noktaları genellikle değişir.
- Örneğin buz içine tuz eklenmesi, erime sıcaklığını düşürür ve buzun daha kolay erimesini sağlar. Bu özellik sayesinde yollardaki buzlanmaları önlemek ve sürüş güvenliğini sağlamak için, yol tuzlaması yapılır.
- Öte yandan suya tuz eklenmesi, kaynamanın gecikmesine ve kaynama sıcaklığının yükselmesine yol açabilir. Bu özellik sayesinde, makarna haşlanırken suyuna tuz atılarak tenceredeki suyun daha yüksek sıcaklıkta kaynaması sağlanarak yemeğin pişme süresi kısaltılabilir.
Basıncın Hâl Değişimi Sıcaklığına Etkisi
Maddelerin hâl değişimi sıcaklıkları basınca bağlı olarak da değişebilir. Basınç arttıkça çoğu maddenin kaynama sıcaklığı yükselir. Günlük hayatta düdüklü tencere örneğinde olduğu gibi basınç arttırılarak su daha yüksek sıcaklıklarda kaynatılır. Böylece yemeklerin pişme süresi kısalır. Buna karşın bazı maddelerde (örneğin büzülerek katılaşan malzemelerde) yüksek basınç, erimeyi kolaylaştırabilir.
Hâl Değişim Isısı (L)
Hâl değişimi sırasında, maddenin sıcaklığı sabit kalır. Bu dönemde maddeye verilen veya maddeden çekilen ısı enerjisi, maddenin iç yapısını değiştirerek faz geçişini gerçekleştirir. Hâl değişim ısısı, 1 kg maddenin tamamen erimesi, donması, buharlaşması ya da yoğunlaşması için gereken ısı miktarıdır. L harfi ile gösterilen hâl değişim ısısının birimi J/kg veya kJ/kg olabilir.
Bir maddenin erime ve donma sıcaklığı ile kaynama ve yoğunlaşma sıcaklığı da birbirine eşittir.
Örneğin 0 °C’deki 1 kg buzu eritebilmek için yaklaşık 334 kJ ısı vermek gerekir. Aynı sıcaklıkta 1 kg suyu dondurmak için de bu ısıyı geri çekmek gerekir. Benzer şekilde 100 °C’de 1 kg suyu buharlaştırmak için 2260 kJ ısıya ihtiyaç duyulur.
Hâl Değişimi Isısı Hesaplaması
Bir maddenin, ilgili hâl değişimi sıcaklığında tamamen faz değiştirmesi için gereken ısı miktarı şöyle hesaplanır:
- Q: Hâl değişimi için gereken ısı (J)
- m: Maddenin kütlesi (kg)
- L: Maddenin hâl değişim ısısı (J/kg)
Bu formülde sıcaklık değişimi olmadığı için, maddenin soğuması veya ısınmasında kullandığımız ifadesi yerine hâl değişim formülü kullanılır.
Örnek Hâl Değişim Sıcaklıkları ve Isıları
Saf maddelerin erime/kaynama noktaları ve hâl değişim ısıları farklıdır. Bazı temel değerler şu şekildedir:
- Buz (su): Erime noktası 0 °C, Erime ısısı ≈ 334 kJ/kg; Kaynama noktası 100 °C, Buharlaşma ısısı ≈ 2260 kJ/kg
- Yemek Tuzu: Erime noktası 801 °C, Kaynama noktası 1465 °C (Erime ısısı ve buharlaşma ısısı çok daha yüksektir.)
- Demir: Erime noktası 1538 °C, Kaynama noktası 2862 °C (Erime ısısı ve buharlaşma ısısı metallere özgü yüksek değerlere sahiptir.)
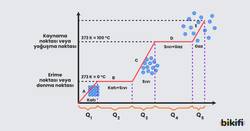
Suyun Hal Değişimi Üzerinden Isı Hesapları
Grafikten hareketle hal değişim ısıları ve ısınması için gereken ısı miktarı hesaplanabilir.
- Buzun sıcaklığının sıfıra doğru artması için gereken ısı miktarı
- Buzun erimesi için gereken ısı miktarı
- Bu ısı miktarı, aynı zamanda suyun buz olması için ortama aktarması gereken ısı miktarına eşittir.
- Suyun sıcaklık artışı için gereken ısı miktarı
- Suyun kaynaması için gereken ısı miktarı
- Bu ısı miktarı, aynı zamanda gaz halde bulunan suyun sıvı hale geçmesi için ortama aktarması gereken ısı miktarına eşittir.
- Gazın sıcaklığının artması için gereken ısı miktarı
Hal Değişimi Hakkında Diğer Bilgiler
Hal değişimi için gerçekleşebilecek durumlar aşağıdaki gibidir.
| Eski Hal\Yeni Hal | Katı | Sıvı | Gaz |
|---|---|---|---|
| Katı | * | Erime | Süblimleşme |
| Sıvı | Donma | * | Buharlaşma |
| Gaz | Kırağlaşma | Yoğunlaşma | * |
- Erime: Katı hâlden sıvı hâle geçiş.
- Donma: Sıvı hâlden katı hâle geçiş.
- Buharlaşma/Kaynama: Sıvı hâlden gaz hâle geçiş.
- Yoğunlaşma: Gaz hâlden sıvı hâle geçiş.
- Süblimleşme: Katı hâlden gaz hâle doğrudan geçiş.
- Kırağılaşma (Depozisyon): Gaz hâlden katı hâle doğrudan geçiş.