Bu yazıda karbon elementini ve özelliklerini; karbonun allotropları olan elmas, grafit, fulleren ve grafeni; karbon nanotüplerin özelliklerini ve karbonun bu kadar fazla sayıda bağ yapabilmesinin nedenlerini ele alınmıştır.
Karbon Elementinin Özellikleri
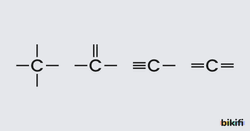
4A grubunda bulunan ve atom numarası 6 olan karbon elementinin 4 değerlik elektronu vardır. Karbon elementi değerlik elektronlarını aynı ya da farklı atomlarla ortaklaşa kullanarak 4 tane kovalent bağ yapar. Bu bağlar teki, ikili ya da üçlü olabilir. Karbonun oluşturabileceği bağ şekilleri aşağıda gösterilmiştir.
Karbon atomları arasında bağlar oluşurken açığa çıkan enerji fazla olduğundan oluşan bu bağlar diğer atomların kendi aralarında yaptıkları bağlara göre daha kararlıdır. Karbon elementi diğer atom veya atom gruplarıyla çok sayıda bağ yapabilir. Karbon atomu düz ve dallanmış zincirli, halkalı, aromatik yapıya sahip çok sayıda bileşik oluşturur.
Karbonun Allotropları
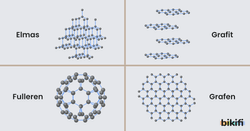
Aynı tür atomların farklı sayı ve dizilişte bir araya gelmesiyle oluşan maddelere allotrop denir. Allotrop maddelerin fiziksel ve bazı kimyasal özellikleri birbirinden farklıdır. Karbonun doğal allotropları elmas ve grafit, laboratuvar ortamında oluşturulmuş yapay allotropları fulleren ve grafendir. Karbon atomlarının farklı şekillerde dizilmesi ile yapay allotroplar oluşturulmaktadır. Karbon nanotüp gibi yeni maddeler teknolojinin gelişmesiyle birlikte bu allotroplardan üretilmektedir.
Elmas
Karbonun düzgün kristal yapıya sahip olan bu allotropu tarih boyunca insanoğlunun zenginliğinin ve gösterişinin simgesi olmuştur. Günümüzde elmasın yeni kullanım alanları da ortaya çıkmaktadır.
Elmas bilinen en sert doğal maddelerden biri olduğundan cam kesici, delici (matkap uçları) ve taş yontucu aletlerde kullanılır. Elmasın bu kadar sert yapıda olmasının nedeni yapısındaki karbon atomlarının bağlanma şeklidir. Elmastaki her bir karbon atomu, çevresindeki diğer dört karbon atomu ile bağ oluşturur. Düzgün dörtyüzlü geometriye sahip kristal yapı oluşturan bu bağlar çok kuvvetlidir. Bağların bu yapısından dolayı elmas elektriği iletmez ancak ısıyı iletir.
Grafit
Grafit; siyah renkli, parlak görünümlü ve yumuşak yapılı bir karbon allotropudur. Karbon atomlarının altıgen halkalar oluşturacak şekilde dizilmesi ile grafit oluşur. Bu altıgen halkalar tabakalar hâlinde arasında zayıf bağlar yaparak birleşir.
Grafit, yapısında bulunan pi bağlarındaki elektronların hareketinden dolayı ısı ve elektriği iletir. Elektriği iletmesi ve erime noktasının yüksek olması grafitin kullanım alanını oldukça genişletir.
Grafitin erime sıcaklığının (3500-3527 °C) çok yüksek olması onun ısıya karşı dayanaklı olmasını sağlar. Bu özelliğinden dolayı metalürjide yüksek sıcaklıklarda ergimiş metal dökülen döküm potalarının yapımında kullanılır.
Grafit; kurşun kalem uçlarının yapımında, kuru pil üretiminde, makine parçalarının üzerine yapışabilme özelliğinden dolayı yağlama malzemesi olarak kullanılmaktadır.
Karbon Nanotüp
Grafite uygulanan özel işlemler sonucu oluşan nanometre boyutundaki silindirik tüplere nanotüp denir. Nanometre metrenin milyarda biridir. Nanotüplerin çapları nanometre, uzunlukları ise milimetre boyutundadır.
Çaplarının milyonlarca katı uzunluklara ulaşabilen karbon nanotüpler; sağlamlık, elektrik iletkenliği, ısı iletkenliği gibi özellikleriyle de diğer malzemelere göre daha kullanışlıdır.
Fulleren
Belirli sayıda karbon atomunun bir araya getirilmesiyle oluşturulan fulleren; top, tüp, çubuk ve halka şeklinde sınıflandırılabilen yapay bir allotroptur. Yapı olarak grafite benzemekle birlikte tabakaları grafitinki gibi değildir. Karbon atomları fullerenin tabakalarında beşgen, altıgen veya yedigen halkalar olarak dizilebilir. Bu halkaların ana düzlemlerinin kıvrılması ile küresel yapılar oluşturulabilir.
Fulleren; güneş pillerinde, hidrojen yakıt depolarında, kurşungeçirmez yeleklerde kullanılır.
Grafen
Sadece karbon atomlarından oluşan sistemler arasında karbon atomunun iki boyutlu allotropu olan grafen, diğer allotropların elektronik özelliklerinin anlaşılabilmesi açısından son derece önemli bir yere sahiptir. Grafen, karbon atomlarının altıgenlerden oluşan bal peteği örgü yapısında sıralanmasından elde edilen iki boyutlu düzlemsel yapıların çok nadir örneklerinden birisidir. Bu yapı, grafene olağanüstü özellikler kazandırmaktadır. Saydam olan grafen tabakası elektriği ve ısıyı çok hızlı bir şekilde iletebilir.
Grafenin yapısı çelikten 6 kat hafif, yoğunluğu çelikten 6 kat daha düşüktür. Çelikten 6 kat daha sert ama 13 kat daha fazla esneme yeteneğine sahiptir.
Grafenin gelecekte süper küçük bilgisayar üretiminden katlanabilir tabletlere, kirlenmeyen kıyafetlerden deri altına yerleştirilebilecek tıbbi cihazlara kadar birçok alanda kullanılabileceğini göstermektedir. Grafenin muhtemel başka bir kullanım alanı da pillere alternatif olacağı düşünülen süperkapasitörlerdir. Bataryaların hızlı şarj edilmesi, radyoaktif atıkların daha kolay temizlenebilmesi, güçlü ve daha sağlam aletler, elektronik kâğıtlar, su geçirmeyen kıyafetler, daha sağlam ve hafif uçaklar, koruma ekipmanları grafenin diğer kullanım alanlarıdır.