İki ya da daha fazla sayıda maddenin oluşturduğu homojen karışımlara çözelti adı verilir. Örneğin hava bir çözeltidir, içersinde azot, oksijen karbondioksit gibi gazlar bulundurur. Çözeltiyi oluşturan bileşenlerden miktarı fazla olan aynı zamanda da aktif çözünme işleminde rol oynayana “çözücü” diğer bileşenlere ise “çözünen” tanımlaması yapılır.
Çözücü – Çözünen Etkileşimleri
Çözeltiyi oluşturan çözücü ve çözünen tanecikleri karışırken çözücü tanecikleri, çözünen taneciklerinin etrafını kuşatır. Dolayısıyla, her iki tür tanecik arasında bir etkileşim oluşur. Bu olaya çözünme denir. Bir maddenin başka bir maddeyi çözebilmesi için, her iki maddenin moleküller arası çekim kuvvetlerinin birbirine yakın olması gerekir. Genellikle, benzer türdeki maddeler birbiri içerisinde çözünür. Yani, polar çözücüler polar yapılı maddeleri çözerken, apolar çözücüler de apolar yapılı maddeleri çözerler.
CH4, CO2, I2, CCI4 ve C2H6 gibi moleküller apolardır ve birbirinde çözünür. Bu tür moleküller arasındaki etkileşim London kuvvetleridir. H2O, CH3CI, HF, H2S gibi sıvılar ise polardır. Bu tür maddeler dipol – dipol etkileşimi oluşturarak birbiri içerisinde çözünür. Güçlü dipol – dipol etkileşimlere ilave olarak bazı moleküllerde hidrojen bağlarından dolayı moleküller arası güçlü çekim kuvvetleri görülebilir.
Örneğin su polar bir bileşik olduğundan dolayı kendisi gibi polar bir molekül olan metanol ile her oranda rahatlıkla karışabilmektedir. Su ve metanol karışımında moleküller arasında hidrojen bağları oluşur bundan dolayı karışım homojen bir görünümdedir.
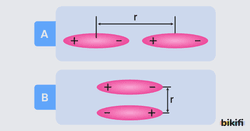
Polar moleküllerin ‘+’ ve ‘–’ kutuplu uçları vardır. Farklı moleküllerin zıt yüklü uçları arasında moleküller arası uzaklığa bağlı olarak etkileşimler iki biçimde görülür.
Bazı çözünme örnekleri
- Apolar molekül olan CCI4‘ün polar molekül olan suda çözünmesi beklenmez. Bunun nedeni H2O(su)- H2O(su) arasındaki dipol-dipol etkileşimlerinin, CCI4–H2O arasında oluşacak dipol-indüklenmiş dipol bağından daha kuvvetli olmasıdır.
- Apolar molekül olan I2 katısı, apolar molekül olan CCI4 sıvısında iyi çözünür. Çünkü I2 – CCI4 arasındaki London kuvvetleri, I2 – I2 moleküllerini ayıracak kadar kuvvetlidir.
- Elmas gibi ağ örgüsü sağlam kristaller ise hiçbir çözücüde çözünmez. Çünkü bu tür kristallerin yapısını bozacak nitelikte bir çözücü – çözünen etkileşimi yoktur.
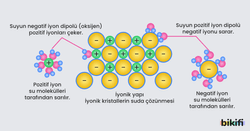
- Çoğu iyonik ve polar kovalent bileşikler için su ideal bir çözücüdür. Çözünme sırasında iyonik maddelerin (+) ve (-) iyonları, polar kovalent maddenin ise dipolleri, polar su molekülleri tarafından elektrostatik olarak çekilirler.
- KCI iyonik ve H2O polar yapılıdır. KCI’nin iyonları su molekülleri tarafından sarılarak çözelti içerisinde tutulurlar. Burada, tuzun pozitif iyonunun (K+) etrafını suyun negatif kısmı sararken, tuzun negatif iyonunun (CI–) etrafını da suyun pozitif kısmı sarar. Bu etkileşime iyon – dipol etkileşimi denir. Su molekülleri K+ ve CI–iyonlarını taşıyarak suda dağıtır. Böylece çözelti meydana gelir.
Hidratlaşma ve Solvatasyon
Çözünen iyonların su molekülleri ile çevrilmesi sonucunda oluşan çözünmeye hidratlaşma (hidratasyon) denir. Çözünme sırasında su yerine başka bir çözücü kullanılırsa hidratlaşma yerine solvatasyon (solvatize olma) kelimesi kullanılır.
Derişim Birimleri
Bir miktar çözeltide çözünmüş olarak bulunan madde miktarına “derişim (konsantrasyon)” denir. Derişim birimi olarak en çok kullanılanlar molarite ve molalitedir.
Molarite (M)
1 litre çözeltide çözünen maddenin mol sayısına molarite veya molar derişim adı verilir. Molarite “M” ile gösterilir. Birimi mol/Litredir.
Molalite(m)
Bir kilogram çözücü içerisinde çözünmüş maddenin mol sayısına molalite denir. Molalite terimi yerine sorularda kısaltma olarak ”molal” kelimesi kullanılır. Molalite “mˮ ile gösterilir. Molalitenin birimi mol/kgʼdır.