Organik bileşiklerin formüllerinde çok sayıda atom bulunabileceğinden dolayı anorganik bileşiklerden farklı olarak organik bileşiklerin birden fazla formülü olabilmektedir. Aynı sınıftaki organik bileşiklerin kimyasal özellikleri genellikle birbirine benzemektedir. Bu yazımızda organik bileşiklerin basit ve molekül formüllerini, bu formüllerle hesaplamalar yapmayı ele alacağız.
Organik kimyada bileşik formülleri; basit, molekül ve yapı formülleri olmak üzere 3 şekilde ifade edilebilir.
Basit formülü (Kaba Formül)
Bileşikteki elementlerin en sade halinin görüldüğü formüle basit formül denir ve elementlerin mol sayıları en küçük tam sayılarla yazılır. Organik bileşiklerdeki elementlerin türünü, atom sayılarının birbirine oranlarını gösteren formüle basit formül (kaba formül) denir.
Bir bileşiğin basit formülünden, bileşiği oluşturan atomların türü, atom sayılarının oranları, elementlerin atom kütleleri biliniyorsa bileşiği oluşturan elementlerin kütleleri oranı ve kütlece yüzde bileşimleri bulunabilir
Molekül Formülü
Bileşik içindeki atomların gerçek sayılarını gösteren formüllere gerçek formül adı verilir. Bir bileşiğin molekül formülü ile bileşiği oluşturan atomların türü, atom sayıları ve atom sayılarının oranları, elementlerin atom kütleleri biliniyorsa bileşiğin molekül ağırlığı, atomların kütlece yüzde bileşimleri ve elementlerin kütleleri oranı bulunabilir.
📌Bilgi: Molekül formülü, basit formülün kütle ya da atom sayısı cinsinden genişletilmiş hâli şeklinde düşünülebilir.
Örneğin: C2H4 bileşiğinin basit formülünü bulmak için C ve H elementlerinin atom sayısı en küçük tam sayı olacak şekilde aynı sadeleştirilir. CH_2 basit formülü elde edilir. Basit formül tekrar n_2 ile çarpılır ise molekül formülüne C2H4 ulaşılır.
Aşağıdaki tabloda beş farklı organik bileşiğin basit formülü ve bileşik formülü verilmiştir. Dikkat edilir ise basit formülleri aynı fakat molekül formülleri farklı olan bileşikler olabilir.
| Molekül Formülü | Basit Formül |
|---|---|
| C4H8 | CH2 |
| C5H10O2 | C5H10O2 |
| C6H10 | C3H5 |
| C2H2O4 | CHO2 |
| C2H4 | CH2 |
Yapı Formülü
Yapı formülünde; moleküldeki atomlar gerçek sayısı kullanılarak atomlar arasındaki bağlanma çizgilerle gösterilir ve atomların birbirlerine nasıl bağlandıkları hakkında bilgi verir.
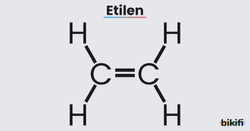
Örneğin; etilenin molekül formülü C2H4‘dür ve basit formülü “CH2“şeklinde gösterilir. Yapısal formülü ise aşağıdaki görselde görüldüğü gibidir.
Kütlece Yüzde Hesaplama
C, H, N ve O elementlerinden oluşan bir bileşikte C, H ve N elementlerinin varlığı nitel analiz yöntemiyle belirlenir. Organik bileşikler bir deney tüpü içerisinde yakıldığında tüpün iç yüzeyinde oluşacak su damlacıkları o bileşikte H elementinin varlığını kanıtlar. Oluşan gazın kireç suyundan geçirilmesi sonucu kireç suyunun bulanması ise bileşikte C elementinin varlığının kanıtıdır. Ancak O elementinin varlığı nicel analiz yöntemleriyle belirlenir. Örneğin 100 g bileşiğin analizi sonucunda C, H ve N elementlerinin kütleleri bulunur. Bulunan değerler bileşikteki her bir elementin kütlece yüzdesidir. Elementlerin kütlece yüzdeleri toplanır ve 100’den çıkarılarak O elementinin kütlece yüzdesi bulunur. Bulunan kütlece yüzdeler elementlerin atom kütlelerine bölünerek mol sayıları hesaplanır. Mol sayıları en küçük tam sayılar şeklinde element sembollerinin altına getirilerek bileşiğin basit formülü yazılır. Bir bileşikteki elementlerin kütlece yüzdeleri aşağıdaki gibi hesaplanır.
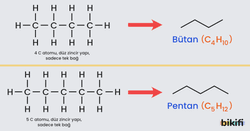
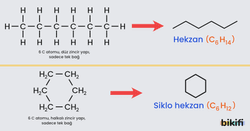
📚 Ek Bilgi: Çizgi-Bağ Formülleri
Yapı formüllerinin daha gelişmiş şekli çizgi-bağ formülleridir.
- Organik kimyada uzun zincirli molekülleri daha kolay göstermek, yazabilmek için çizgi bağ formülü kullanılmaktadır.
- Çizgi bağ formülü sadece karbon atomlarını gösterdiği için yazımı oldukça hızlıdır.
- Hidrojen çizgi bağ formülünde yazılmaz ama oksijen, klor, azot gibi atomlar çizgi bağ formülünde yazılırlar.
- Her köşeye ve her çizginin sonuna başka bir atom yazılmadığı sürece çizgiler bir karbon atomunu gösterirler.
- Çizgi bağ formülü yazarken önce Hidrojen atomları sonra karbon atomları çıkartılır. Daha sonra çizgi ile gösterilir.