Tepkime hızı dışarıdan gözlemleyebildiğimiz, belirgin fiziksel veya kimyasal özellik değişimi sayesinde ölçülebilir. Bu belirgin özellikler arasında;
- Basınç değişimi
- Hacim değişimi
- Renk değişimi
- Derişim değişimi
- İletkenlik değişimi
- Ph değeri değişimi
gibi özellikler verilebilir. Örneğin başlangıçtaki rengi bilinen bir tepkimenin renk değişim hızını ölçerek tepkimenin hızı hakkında veri elde edebiliriz. Aynı durum başlıca ph değişiminde veya iletkenlik değişiminde olmak üzere diğer özellik değişimlerinde de gözlemlenebilir.
Hız Denklemi
Bir tepkimenin hızını, tepkimeye giren maddelerin derişimlerine göre yazılmasına hız denklemi denilir. Hız denkleminde derişim kullanıldığı için saf katılar ve sıvılar hız denkleminde yer almaz; hız denkleminde sadece gaz ve çözelti halinde bulunan giren ürünler yazılır.
Orantı Sabiti (k)
Tepken maddelerin derişiminin artması taneciklerin çarpışma sayısını arttırır ve böylece etkin çarpışma sayısı artar. Etkin çarpışma sayısının artması tepkimenin hızını arttırır. Bu yüzden giren maddelerin derişimleriyle tepkime hızı arasında bir oran vardır. Bu orana orantı sabiti denilir ve ile gösterilir. Orantı sabiti her tepkimede değişiklik gösteren bir sabittir. Yani her tepkimenin kendisine has bir orantı sabiti vardır.
Hız Denkleminin Yazılması
Hız denklemini, hız sabitine () ve tepken derişimlerine göre yazılmasına hız yasası denilir. Hız denklemi mekanizmalı tepkimelerde ve ara basamaksız tepkimelerde farklı yazılır. Hız denkleminde şu kurallara uyulması gerekir:
- Hız denkleminde katıların ve sıvıların derişimi yazılmaz.
- Hız denkleminde sadece gazların ve çözelti halinde bulunan maddelerin derişimi yazılır.
- Her hız denkleminde tepkimeden tepkimeye değişen bir hız sabiti () bulunur.
- Hız sabiti () tepkimenin o anki sıcaklığına bağlıdır. Yani yüksek sıcaklıkta gerçekleşen bir tepkimenin değeri daha yüksektir.
- Hız sabiti () tepkimenin o anki eşik enerjisine de bağlıdır. Eşik enerjisi ne kadar düşük olursa sabiti de o kadar yüksek olur yani eşik enerjisi düştükçe tepkime hızlanır.
- Hız yasasında yer alan tepken derişimlerinin üstleri toplamına tepkimenin derecesi denilir.
Örnek #1 – Homojen Bir Tepkimenin Hızının Yazılması
- Tepkimenin derecesi =
- = Tepkimenin hız denklemi =
- Yukarıdaki örnekte giren ürünlerin hepsi gaz olduğu için tepkime hız denklemi tepken maddelerin kısmi basınçları cinsinden de yazılabilir
- Kısmi basınca göre hız denklemi = =
- Kısmi basınçtaki hız sabiti () değeri molar derişim cinsinden yazılan sabitine eşit değildir (birimleri farklıdır).
Örnek #2 – Heterojen Bir Tepkimenin Hızının Yazılması
- Tepkimenin derecesi =
- r = Tepkimenin hız denklemi =
- Eğer = 1 ise;
- sabitinin birimi 1/s’dir
- (tepkime hızının birimi) mol/L.s ‘dir.
- Eğer = 2 ise;
- ‘nın birimi L/mol.s ‘dir
- ‘nin birimi mol/L.s ‘dir
- Eğer = 3 ise;
- ‘ nın birimi L/mol.s ‘dir
- ‘nin birimi mol/L.s ‘dir
Örnek #3
- Tepkimenin derecesi = 0
- = Tepkimenin hız denklemi =
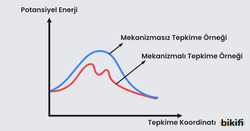
Mekanizmalı Tepkimelerde Hız Denklemi
Gerçek hayatta tepkimeler nadiren tek bir basamakta gerçekleşir. Tek basamakta gerçekleşmeyen tepkimelerde ara tepkime basamakları gözlemlenir. Ara tepkime basamakları gözlemlenen tepkimelere mekanizmalı tepkimeler denilir. Mekanizmalı tepkimelerde taraf tarafa toplama yaptığınız zaman oluşan tek tepkimeye mekanizmalı tepkimenin genel tepkimesi denilir.
- Mekanizmalı tepkimelerde hız denklemi yavaş basamağa göre yazılır.
- Tepkime mekanizmasında üretilen ve sonrasında harcanan maddelere ara ürün denilir. Ara ürünler net tepkimede yer almaz
Örnek bir mekanizmalı tepkime
NO(g) + Cl2(g) => NOCl2(g) (hızlı)
NOCl2(g) + NO(g) => 2NOCl(g) (yavaş)
—————————————————————
2 NO(g) + Cl2 => 2NOCl(g) (Net Tepkime)
Yukarıda örnek bir mekanizmalı tepkime verilmiştir. Bu verilen tepkime mekanizmasına göre şu verileri yorumlayabiliriz
- Tepkime hız denklemi = r = k . [NOCl2] . [NO]
- Tepkimenin derecesi = 1+1 = 2
- Ara ürün = NOCl2(g)
Homojen ve Heterojen Faz Tepkimeleri
Kimyasal tepkimeler, giren ve ürünlerin fiziksel hallerine göre homojen ve heterojen olarak sınıflandırılabilir. Eğer girenlerin ve ürünlerin hepsinin fiziksel halleri aynıysa homojen faz tepkimesi olarak adlandırılır. Eğer girenlerin ve ürünlerin fiziksel halleri farklıysa o tepkime heterojen faz tepkimesi olarak adlandırılır.