Kimyasal tepkimelerde hızı kontrol altında tutarak stabil ve istenen bir sonuca ulaşmak çok önemlidir. Örneğin araba kazalarındaki ölüm oranının azaltmak için çok hızlı bir gaz çıkışına sahip bir denkleme ihtiyaç duyulur. Kimyasal reaksiyonların hızına etki eden faktörler şunlardır:
- Madde cinsi
- Derişim
- Sıcaklık
- Katalizör
- Temas yüzeyi
Derişim
Tepkime hızı etkin çarpışma sayısına bağlıdır. Etkin çarpışma sayısını arttıran faktörler tepkime hızını da artıracaktır. Etkin çarpışma sayısını artıran faktörlerden biri de tepkimeye giren maddelerin derişimidir.
Madde Cinsi
Kimyasal tepkimelerde giren maddenin cinsi tepkimenin hızına etki eden en önemli faktördür. Giren maddenin cinsi ve kimyasal özellikleri; moleküller arasındaki bağın gücünü ve o bağı kırmak için gereken enerjiyi belirler. Giren maddenin tepkimeye girme isteğine göre tepkime hızı değişiklik gösterir.
Sıcaklık
Sıcaklık artışı tanecikleri hızlandırır. Hızlanan tanecikler birbirleriyle daha çok çarpışmaya başlarlar. Bu sayede sıcaklık artışı taneciklerin çarpışma sayısını arttırdığı için tepkimeyi hızlandırır. Buna örnek olarak dışarıda beklemiş bir yemeğin buzdolabında beklemiş bir yemeğe göre daha hızlı bozulması verilebilir.
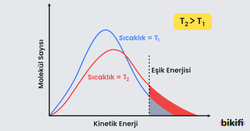
Sıcaklığın tepkime üzerindeki etkisi Maxwell – Boltzman dağılım eğrisi üzerinde gösterilir. Aşağıdaki grafik belirli bir kinetik enerjideki molekül sayılarını vermektedir. Daha küçük olan tümsek daha büyük sayıda molekülün daha hızlı hareket ettiği anlamına gelmektedir.
Katalizör
Kimyasal bir tepkimeye dışarıdan eklenen ve tepkime sonucu değişime uğramadan çıkan, tepkimenin hızını değiştirebilen maddelere katalizör denilir. Katalizörler tepkimeleri mekanizmalara böler. Katalizörler net tepkime denkleminde okun üzerine yazılır.
İki çeşit katalizör vardır. Bunlardan birisi tepkimeyi hızlandıran pozitif katalizör. Diğeri ise tepkimeyi yavaşlatan negatif katalizör veya (inhibitör).
Katalizörlerin Genel Özellikleri
- Katalizör hız denkleminde hız sabitini değiştirerek tepkime hızına etki eder.
- Her tepkimede katalizör kullanılmak zorunda değildir.
- Katalizör, aktfileşmiş kompleksin enerjisini düşürür böylece ileri ve geri aktifleşme enerjisini aynı miktarda arttırır veya azaltır.
- Katalizör, tepkimenin mekanizmasını değiştirir.
- Katalizörün tepkimenin entalpi değişimi üzerinde bir etkisi yoktur.
- Katalizörler tepkime sonunda eksilmeden veya herhangi bir yapısal değişikliğe uğramadan, girdikleri gibi çıkar.
Temas Yüzeyi
Temas yüzeyinin artması etken maddeler arasındaki teması ve etkileşimi arttırması sayesinde tepkimenin hızına etki eder. Örneğin çaya atılan toz şeker, küp şekere göre daha çabuk çözünür. Daha fazla yüzey alanı = daha çok etkileşim = daha çok molekül kopması = daha hızlı tepkime.