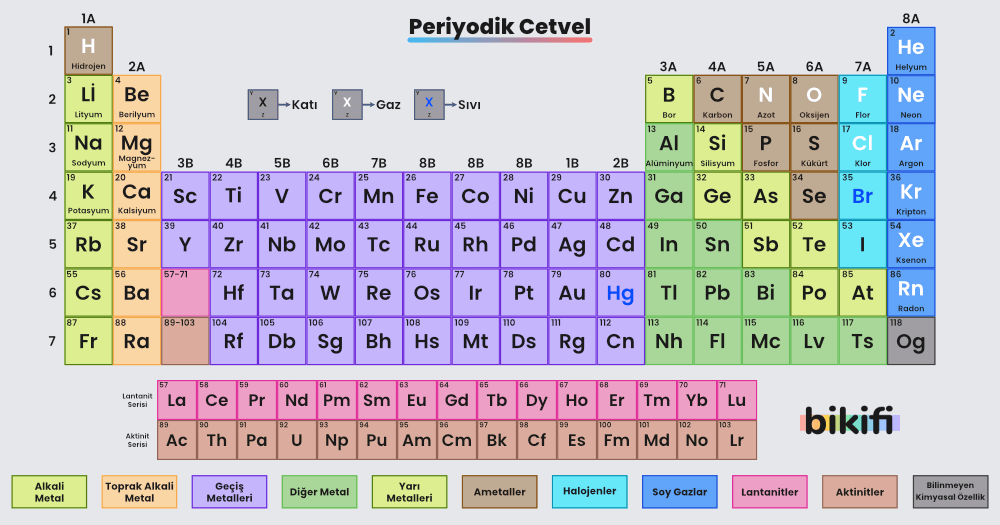
Periyodik tablo, elementleri belirli özelliklerine göre gruplandırarak daha kolay anlaşılmalarını ve incelenmelerini sağlar. Bu tabloda, elementlerin benzer kimyasal özelliklere sahip olanları aynı dikey sütunda (grup) bulunur. Yatay sıralar (periyotlar) ise elementlerin katman (enerji seviyesi) sayısını yansıtır. Günümüzde kullandığımız modern periyodik tablo, Johann Wolfgang Döbereiner, John Newlands, Julius Lothar Meyer ve Dimitri Mendeleev gibi bilim insanlarının çalışmalarının bir sonucudur.
- Dikey Sütunlar (Gruplar): Benzer kimyasal özelliklere sahip elementler aynı grupta yer alır. Örneğin, alkali metaller (1A grubu) ve halojenler (7A grubu) aynı sütunda sıralanır.
- Yatay Sıralar (Periyotlar): Elementler, atomlarının enerji seviyelerine (elektron kabuk sayısına) göre periyotlara ayrılır. Örneğin, 3. periyotta yer alan bir elementin en yüksek enerji seviyesi 3. katmandır.
Moseleyin çalışmaları ve düzenlediği periyodik yasaya göre elementleri artan atom sırasına göre yan yana, benzer özelliklerine göre de alt alta sıralayan bir periyodik tablo oluşturulmuştur. Günümüzde kullanılan periyodik tabloyu yukarıda görebilirsiniz. Periyodik tabloyla ilgili bilgiler bulabileceğiniz etkileşimli periyodik cetvel => https://www.ptable.com/?lang=tr.
Periyodik Tablo Nasıl Oluşturulmuştur?
Modern periyodik tablo, tarihsel olarak birçok bilim insanının katkılarıyla gelişmiştir:
- Döbereiner: Elementler arasında üçlü gruplar oluşturarak benzerlikler aramıştır.
- Newlands: Artan atom ağırlığına göre benzer özellik gösteren elementleri sıralamıştır.
- Mendeleev: Boşluklar bırakarak henüz keşfedilmemiş elementler için yer öngörüsünde bulunmuştur.
- Moseley: Atom numarasının (proton sayısının) elementlerin yerini belirlediğini göstererek tabloyu modern hâline getirmiştir.
Bu bilim insanlarının çalışmaları sonucunda, elementler artan atom numarasına göre ve benzer özelliklere göre gruplandırılmıştır.
Periyodik Tabloda Yer Bulma Kuralları
- Elektron Dizilimi ve Periyot Belirleme
- Bir elementin elektron diziliminde en yüksek baş kuantum sayısına sahip katman (örneğin 3s, 4p gibi), elementin periyot numarasını gösterir.
- Örneğin, elektron dizilimi olan sodyum (Na) elementinde, en yüksek enerji seviyesi 3. katmandır. Bu nedenle sodyum 3. periyotta yer alır.
- Elektron Dizilimi ve Grup Belirleme
- Gruplar, elementlerin en dış katman (valans) elektron sayısına göre belirlenir.
- s ve p blok elementlerinde, en dış katmandaki toplam elektron sayısı A grubunun numarasını verir. Örneğin, elektron dizilimi olan oksijen (O) için en dış katmanda 2s² ve 2p⁴ olmak üzere toplam 6 elektron vardır. Bu element, 6A grubunda yer alır.
- d blok elementlerinde (geçiş metalleri) ise grup numarası, s ve d orbitallerindeki toplam valans elektron sayısına göre bulunur.
Periyodik Tablo Blokları
Periyodik tablo, elektron diziliminde en yüksek enerjili orbitalin türüne göre dört ana bloğa ayrılır:
- s Blok: 1A ve 2A grupları (helyum hariç) burada yer alır. Bu elementlerin en dış kabuğunda genellikle 1 veya 2 elektron bulunur.
- p Blok: 3A, 4A, 5A, 6A, 7A, 8A (veya 0) grupları bu bloğa dahildir. En dış kabukları 3. periyot veya daha yüksek periyotlarda olan elementleri içerir.
- d Blok: Geçiş metalleri olarak bilinen elementler burada yer alır.
- f Blok: Lantanidler ve aktinidler olarak bilinen iç geçiş metalleri bu bloğa dahildir.
Bazı Gruplar ve Özellikleri
Periyodik tablonun A gruplarında yer alan elementler, günlük hayatta sıkça karşılaştığımız maddeleri oluşturur. Bu grupların genel özelliklerini bilmek, elementlerin kimyasal davranışlarını ve kullanım alanlarını anlamayı kolaylaştırır.
1A Grubunun Genel Özellikleri
- 1A grubu elementleri, hidrojen (H) hariç alkali metaller olarak adlandırılır. Lityum (Li), sodyum (Na), potasyum (K) gibi elementler bu gruba örnektir.
- Alkali metallerin en dış katmanında sadece 1 elektron bulunur. Dolayısıyla elektron dizilimlerinin son kısmı genellikle şeklindedir.
- Yumuşak ve kesilebilir olmaları, parlak yüzeye sahip olmaları ve suyla şiddetli tepkime vermeleri en belirgin özellikleridir.
- Günlük hayatta en bilinen örneği, sofra tuzunun yapısındaki sodyum (Na) iyonudur. Sodyum, kimya sanayinde ve aydınlatma lambalarında da kullanılır.
2A Grubunun Genel Özellikleri
- 2A grubu elementleri toprak alkali metaller olarak adlandırılır. Berilyum (Be), magnezyum (Mg), kalsiyum (Ca) bu gruba örnektir.
- En dış katmanlarında 2 elektron bulunur. Bu nedenle elektron dizilimlerinin son kısmı genellikle şeklindedir.
- Magnezyum (Mg), hafifliği nedeniyle uçak ve araba parçalarının yapımında kullanılırken, kalsiyum (Ca) insan vücudunda kemik ve dişlerin yapı taşıdır.
7A Grubunun Genel Özellikleri
- 7A grubu elementleri halojenler olarak bilinir. Flor (F), klor (Cl), brom (Br), iyot (I) bu gruba dahildir.
- Halojenlerin en dış katmanlarında 7 elektron bulunur. Elektron dizilimlerinin son kısmı genellikle şeklindedir.
- Oldukça reaktif olan bu elementler, doğada genellikle bileşik hâlinde bulunurlar. Örneğin, sodyum klorür (NaCl) yani sofra tuzu, sodyum (Na) ve klor (Cl) elementlerinin birleşmesiyle oluşur.
- Halojenler, dezenfektan ve ağartıcı olarak ya da endüstride çeşitli organik bileşiklerin üretiminde kullanılır.
- Tepkimeye girmeye eğilimindedirler (özellikle alkali metal ve toprak alkali metalleri ile).
8A Grubunun Genel Özellikleri
- 8A grubu elementleri, asal (soy) gazlar olarak adlandırılır. Helyum (He), neon (Ne), argon (Ar), kripton (Kr), ksenon (Xe) bu grupta yer alır.
- En dış katmanlarında tam dolu elektron dizilimi vardır. Bu nedenle genellikle başka atomlarla kolayca reaksiyona girmezler.
- Neon (Ne) ve argon (Ar) gibi elementler, reklam panolarında ve aydınlatma teknolojisinde sıklıkla kullanılır. Neon lambalarının parlak renkleri, neon gazının elektrikle uyarılması sonucu ortaya çıkar.
- Bütün asal gazlar havanın içerisinde bulunur (hatta havanın %1’i argondan oluşmaktadır).
Atomdan İyona
- Nötr Atom: Proton sayısı ile elektron sayısı eşittir. Elektron dizilimi, atomun kimyasal özelliklerini belirler.
- Kararlı Durum: Atomlar, en dış kabuğundaki elektron sayısını soygazlara benzetmeye çalışır. Bu duruma ulaşmak için elektron alabilir veya verebilirler.
Elementlerin elektron dizilimleri, onların kimyasal tepkimelerde nasıl davranacağını belirleyen temel faktörlerden biridir. Bazı elementler elektron vererek pozitif yüklü iyon (katyon) hâline gelirken, bazıları elektron alarak negatif yüklü iyon (anyon) oluştururlar.
İyon Oluşumu
Bir atom, kararlı bir elektron dizilimine ulaşmak için elektron alabilir veya verebilir.
- Pozitif yüklü iyon (katyon) oluşumu, atomun elektron kaybetmesi ile gerçekleşir. Örneğin, sodyum (Na) atomu 1 elektron vererek hâline gelir.
- Negatif yüklü iyon (anyon) oluşumu, atomun elektron kazanması ile gerçekleşir. Örneğin, klor (Cl) atomu 1 elektron alarak hâline gelir.
Özellikle 1A grubu elementleri, tek bir elektron kaybederek +1 yüklü katyon oluşturma eğilimindedir. 7A grubu elementleri ise tek bir elektron alarak -1 yüklü anyon oluşturur. Bu davranış, elementlerin oktet kuralı (son katmanda 8 elektronlu düzen) veya duet kuralı (Helyum için 2 elektronlu düzen) ile açıklanır.
- Oktet Kuralı: Oktet kuralı atomların son katmanındaki elektron dizilimini soy gazlara benzetmeye çalışır. Yani son katmandaki elektron sayısını 8e tamamlar. Örnek: CO2 molekülü oktet kuralına uyar.
- Dublet Kuralı: Son katmanın, helyuma benzemek isteyen elementlerde gözlemlenen kuraldır. Yani elektron sayısını ikiye tamamlamak için kullanılır. Örnek olarak lityumun oluşturduğu bileşikler verilebilir.
Nasıl Düşünmeli?
Her elementin önce nötr atom hâlindeki elektron dizilimi incelenir. Ardından, atomun kararlı hâle geçmek için elektron alması mı yoksa vermesi mi daha kolay olduğuna bakılır. Örneğin:
- Sodyum (Na): dizilimine sahiptir. 3s orbitalindeki 1 elektronu vererek (1s² 2s² 2p⁶) hâline geçer.
- Klor (Cl): dizilimine sahiptir. Bir elektron alarak 3p⁶ düzenine ulaşır ve olur.
İzolelektronik Tanecikler
İzolelektronik tanecikler, aynı elektron dizilimine sahip fakat farklı proton (dolayısıyla farklı çekirdek) sayılarına sahip iyonlardır. Örneğin,
- , , ve atomu birbirleriyle izolelektronik olabilir. Hepsinin elektron sayısı ve elektron dizilimi 10 elektronlu olacak biçimde aynı düzene sahiptir: .