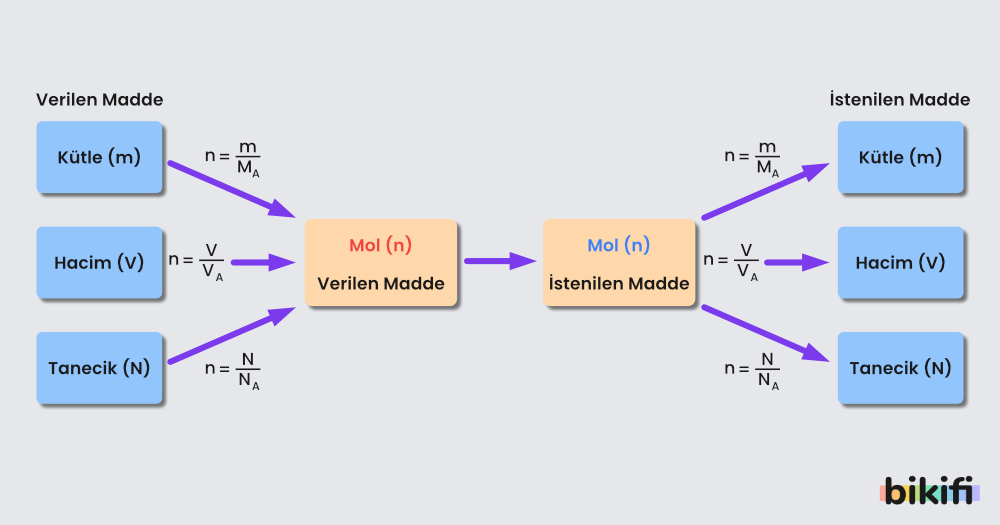
Mol Kavramı
Mol kelimesi Latincede büyük yığın anlamındadır. Mol kavramı, çok büyük sayıları ifade etmekte kullanılan trilyon ve katrilyona benzemekle beraber onlardan çok daha büyük bir miktar birimidir. Nasıl ki tek tek sayılar yerine düzine ifadesini kullanmak, sayım işleminde kolaylık sağlıyorsa kimyada da atomların sayımı için mol ifadesi birim olarak kolaylık sağlar. Mol kavramı bilimsel olarak karbon 12C izotopunun atomlarıyla tanımlanmış olsa da her tür kimyasal için geçerli bir kavramdır.
Mol Kavramının Tarihçesi
Kimyacılar Dalton’dan başlayarak bağıl sayıların kullanımının önemini kavramaya başladılar. Bir azot molekülü oluşurken bir tane azot, üç tane hidrojen atomu birleşir şeklinde ifade ettiler. Benzer şekilde atom ve molekül miktarını belirtmek için de mol kavramını kullandılar. Örneğin; Karbon elementinin bağıl atom kütlesi kadar gram elemente 1 mol element dediler. Bu sebeple 12 gram karbon-12 izotopunun içerdiği atom sayısı oluslararası birim (SI) sistemine göre 1 moldür.
1 mol denildiği zaman 602.000.000.000.000.000.000.000 tane veya daha kısa olarak 6,02×1023 sayısıyla ifade edilir. Bu sayıya Avogadro sayısı adı verilir ve NA ile gösterilir. Mol, herhangi bir maddenin Avogadro sayısı (6,02×1023 ) kadar tanecik (atom, molekül, formül birim, iyon ) içeren miktarına denir.
İki ayrı atom yerine kuş tüyüyle taş düşünelim 6,02.1023 tane kuş tüyünü toplayıp bir yığın yapalım. Ayrı bir yerde de yine 6,02.1023 tane taşı toplayıp yığalım. Her iki tarafta da eşit sayıda kuş tüyü ve taş bulunacaktır. Yani 1 mol kuş tüyü ve 1 mol taş elde etmiş oluruz. Her iki yığın ayrı ayrı tartıldığında aralarında büyük bir ağırlık farkı olduğu görülür çünkü bir tek taş, bir tek kuş tüyünden çok daha ağır olduğundan taş yığını, kuş tüyü yığınından çok daha ağır olacaktır. Yani mol sayısı cisimlerin ağırlığı i�çin kullanılan bir birim değildir.
Mol belirtilirken molün ait olduğu nesne mutlaka belirtilmelidir. Aşağıda bu ifadeye ait örnekler verilmiştir;
- 6,02.1023 tane kuş tüyü = 1 mol kuş tüyü
- 6,02.1023 tane çelik bilye= 1 mol çelik bilye
- 6,02.1023 tane elma= 1 mol elma
- 6,02.1023 tane Hidrojen atomu = 1 mol hidrojen atomu
- 6,02.1023 tane Azot molekülü= 1 mol azot molekülü
- 6,02.1023 tane Gümüş molekülü =1 mol gümüş iyonu
- 6,02.1023 tane BaCl2 molekülü =1 mol BaCl2 molekülü
N tane tanecik içeren bir madde örneğinin mol olarak eş değeri (n), tanecik sayısının(N), Avogadro Sayısına (NA) bölünmesiyle bulunur. Formülle ifade edecek olursak;
şeklinde ifade edebiliriz.
Bağıl Atom Kütlesi
Bir tane atomun kütlesi mutlak olarak ölçülemediğinden bir atomun referans olarak seçilen başka bir atomun kütlesinden kaç kat ağır olduğunu gösteren sayıta bağıl atom kütlesi denir.
Atom Kütlesi
1 mol 12C izotopu yani 6,02×1023 tane 12C izotopu tartıldığında 12 gram gelmiştir. Tek bir 12C izotopu ise 1,9926.10-23 gramdır.
1,9926.10-23 gram . 6,02.1023 = 12 gramdır.
12C izotopunun atom kütlesi 12 kabul edilmiş ve bunun 1/12’sine 1 atomik kütle birimi(akb) denmiştir. Örneğin hidrojen atomunun kütlesi 1,67×10-24 gramdır fakat bu kadar küçük sayıyla hesaplama yapmak pratik değildir. Bu nedenle atomların kütleleri belirtilirken birim olarak gram değil, atomik kütle birimi (akb) kullanılır.
- Atomik kütle birimi de çok küçük bir birim olduğundan maddelerin kütleleriyle ilgilenirken tek bir atomun ya da molekülün kütlesi yerine 6,02×1023 taneciğin (1 mol taneciğin) kütlesini kullanmak daha uygundur.
- Bir elementin 1 mol atomunun gram cinsinden kütlesiyle o elementin ortalama atom kütlesi aynı sayıyla ifade edilir.
- Örneğin; 1 mol magnezyum atomunun kütlesi 24,3 g, bir magnezyumun ortalama atom kütlesi ise 24,3 akb’dir. Bu 24,3 sayısına magnezyum elementinin atom kütlesi veya atom ağırlığı denir.
Molekül Kütlesi ve Mol Kütlesi
Bir maddenin 1 molünün gram cinsinden kütlesine, o maddenin mol kütlesi denir ve M ile gösterilir. Mol kütlesinin birimi g/mol’dür. Bir elementin bir atomunun gram olarak kütlesi yani gerçek kütlesi;
formülüyle bulunur. Molekül yapılı bir element veya bileşiğinin 1 molünün gram olarak kütlesi de mol kütlesi olarak tanımlanır. Kimyasal hesaplamalarda temel birim; atom için atom kütlesi, moleküller için molekül kütlesi ve formül birimi için formül kütlesi olarak alınır. Örneğin; O2 molekülünün kütlesi 16.2=32 gramdır. Tek bir oksijen atomunun kütlesi ise oksijen molekülünün kütlesinin Avogadro sayısına bölümüyle bulunur.
bağıntısıyla bulunur.
yazılabilir.
Bir maddenin belirli bir kütlesinin kaç mol olduğu , verilen kütlenin, mol kütlesine bölümü ile bulur.
🧪Örnek: Fe:56, S:32, O:16 olduğuna göre Fe2(SO4)3‘ ın mol kütlesi;
2 mol Fe atomu = 2.56=112 g
3 mol S atomu = 3.32 = 96 g
12 mol O atomu = 12.16 =192 g
Fe2(SO4)3 = 400 g/mol bulunur.
🧪Örnek: MgCl2 ve (NH4)3 PO4 bileşiklerinin mol kütlelerini bulalım;
(Mg:24, Cl:35,5 N:14, H:1, P:31, O:16)
1 mol Mg=1.24 = 24
2 mol Cl = 2.35,5 = 71 bulunur ve sonuç 95 g olur.
🧪Örnek: (NH4)3PO4 içim
3 mol N = 3.14 =42
12 mol H= 12.1=12
1 mol P = 1.31=31
4 mol O= 4.16 =64 sonuçlar toplandığında 149 g olarak bulunur.
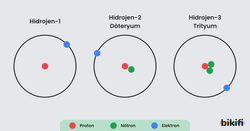
İzotop Kavramı ve Elementlerin Mol Kütleleri
Atom numaraları aynı kütle numarası farklı olan atomlara izotop atomlar denir. İzotop atomlarda kütle numarası farklı olmasının sebebi nötron sayıları farkıdır. Hidrojen atomunun izotopları aşağıdaki gibidir.
| Hidrojen | Döteryum | Trityum |
- Atomların kimyasal özellikleri proton ve elektron sayısı ile ilişkilidir.
- Atomun elektron sayısı değiştiğinde kimyasal özellikleri de değişir.
- Nötronların kimyasal özelliğe etkisi azdır. Nötronlar fiziksel özellikleri belirler. Bu nedenle izotop atomların kimyasal özellikleri aynı, fiziksel özellikleri farklıdır.
🚨Uyarı: Elektron sayısı farklı olan izotopların fiziksel ve kimyasal özellikleri de farklıdır.
Ortalama Atom Kütlesi
Elementlarin doğada birçok izotopu var olduğu için doğada bolluk yüzdelerinden ve atom kütlelerinden yararlanarak ortalama atom kütleleri (OAK) hesaplanır.
Ortalama Atom Kütlesi
🧪Örnek: X1 izotopun atom kütlesi 34,9688 akb, doğada bolluk yüzdesi %75,77; X2 izotopun atom kütlesi 36,9659 akb, doğada bolluk yüzdesi %24,23 olduğuna göre X atomunun ortalama atom kütlesi kaç akb’dir?
OAK=35,5 akb’dir.
🚨Uyarı: Elementlerin atom kütlelerinin tam sayı çıkmayışının nedeni, her bir izotopun kütlesinin kesirli bir sayı olması ve doğada bolluk yüzdelerinin farklı olasıdır.
Mol Hesaplamaları
Bir mol, Avogadro sayısı kadar taneciğin miktarını ifade ettiği için kimyada madde miktarı mol cinsinden ifade edilir. Mol, kimyada en çok kullanılan birim sistemidir.
Kimyasal hesaplamalarda madde miktarı mol birimine dönüştürüldüğünde stokiyometrik işlemler mol türünden yapıldığı için kimyasal hesaplamalara mol hesaplamalrı denir.
Maddenin Miktarının Mol Cinsinden Hesabı
Kütlesi Verilen Maddenin Mol Sayısı
Mol-Kütle hesaplamaları olarak da bilinir.
🧪Örnek: 160 gram Ca kaç moldür ve kaç atom içerir?
– m=160 g MA=40g/mol ise
– n=4 mol NA=6,02.1023 ise N=n.NA N=4 . 6,02.1023=2,408.1024 tane atom
Tanecik Sayısı Verilen Maddenin Mol Sayısı
Normal Şartlar Altında (0°, 1 atm) Verilen Maddenin Mol Sayısı
Bu hesaplama yöntemine mol-hacim hesaplamaları da denilmektedir.
Normal şartlar altında (NŞA) bütün gazların 1 molleri 22,4 L hacim kaplar.