Atom hakkındaki fikirler çok eski olmasına rağmen 20. yüzyıla kadar öznel yargılardan öteye gidememiştir. Maddenin atomlardan oluştuğu fikri çok eski olsa da onun hakkında edinilen bilgiler oldukça yeni sayılır. Yunan filozoflar tarafından bölünemez en küçük parça olduğu düşünülen atom hakkında birçok teori ortaya atılmıştır ve geçerliliğini zaman içinde yitirmiştir (Atom sözcüğü Yunancada “bölünemez” anlamına gelen atomos sözcüğünden türetilmiştir). Bugünkü bilgilerimizle atomun çok küçük olduğunu, artı yüklü bir çekirdekten oluştuğunu ve çekirdeğin çevresinde elektronların bulunduğunu bilmekteyiz. Aynı zamanda elektromanyetik ışıma yaptığını ve elektriksel olarak nötr olduğunu söyleyebiliriz.
Atom, bir elementin bütün özelliklerini taşıyan en küçük parçacığıdır. Yalnızca taramalı tünel mikroskobu (atomik kuvvet mikroskobu) ile incelenebilir.
Eski Yunan atom kuramları planlı deneylere dayanmıyordu. Bunun için yaklaşık 2000 yıllık bir zaman diliminde atom kuramı sadece tartışılmaktan öteye gidemedi. John Dalton’un 1803-1808 yılları arasında geliştirip önerdiği atom kuramı kimya tarihinde en önemli aşamalardan biri olmuştur.

Atomla İlgili Düşünceler
Dalton Atom Modeli
Kimyanın temel yasalarından olan sabit ve katlı oranlar yasalarından gidilerek ilk atom modeli olan Dalton atom modeli ortaya atılmıştır. Bu model aşağıdaki gibi özetlenebilir:
- Madde atom adı verilen çok küçük ve bölünemeyen taneciklerden oluşmuştur.
- Kimyasal tepkimelerde atomlar bir bütün olarak davranır. Atomlar parçalanamaz ya da yeniden oluşturulamaz.
- Bir elementin bütün atomları şekil, büyüklük ve kütle bakımından birbirinin aynıdır. Ancak diğer elementlerin atomlarından farklıdır.
- Atomlar birleşerek molekülleri oluşturur. Bir bileşikteki tüm moleküller birbirinin aynıdır. Molekül içindeki atom sayıları arasında basit bir oran vardır.
Dalton atom modelinin eksiklikleri:
- Maddelerin en k�üçük yapı taşı atom değildir.
- Atomların içi tamamen dolu değildir. Büyük oranda boşluklar vardır. Ayrıca sadece küresel olmayıp farklı yapılara sahiptir
- Atomlar nükleer yollarla parçalanabilir.
- Aynı cins elementlerin atomları, büyüklük ve kütlece birbirinin aynısı değildir. (İzotop atom)
- Farklı cins elementlerin atomları da farklıdır.
- Bir bileşiği oluşturan atomların kütleleri arasında basit tam sayılarla ifade edilen bir oran vardır
Dalton Atom Modeli İle Modern Atom Teorisi Karşılaştırması
| Dalton Atom Teorisi | Modern Atom Teorisi |
|---|---|
| Atom en küçük parçacıktır ve bütün elementler atomlardan meydana gelir. | Atomu oluşturen parçacıkların bulunması atomun en küçük yapı olmadığını göstermiştir. |
| Atom bölünemez, parçalanamaz ve yeniden oluşturulamaz. | Atomlar çekirdek tepkimeleri sonucu parçalanabilir veya başka bir atoma dönüşebilir (fisyon ve füzyon). |
| Bir elementin bütün atomlarının boyutları kütleleri ve kimyasal özellikleri aynıdır. Farklı elementlerin atomları ise kendi içinde aynı diğer elementlerden faklıdır. | Bir elementin kimyasal özellikleri aynı olsa dahi fiziksel özellikleri ve kütleleri farklı olabilir (izotop). |
| Bileşikler birden çok elementin atomlarından oluşur. | Bileşikler birden çok elementin atomlarından oluşur. |
| Atomlar içi dolu kürelerdir. | Atomlar boşluklu yapılardır. |
Thomson Atom Modeli
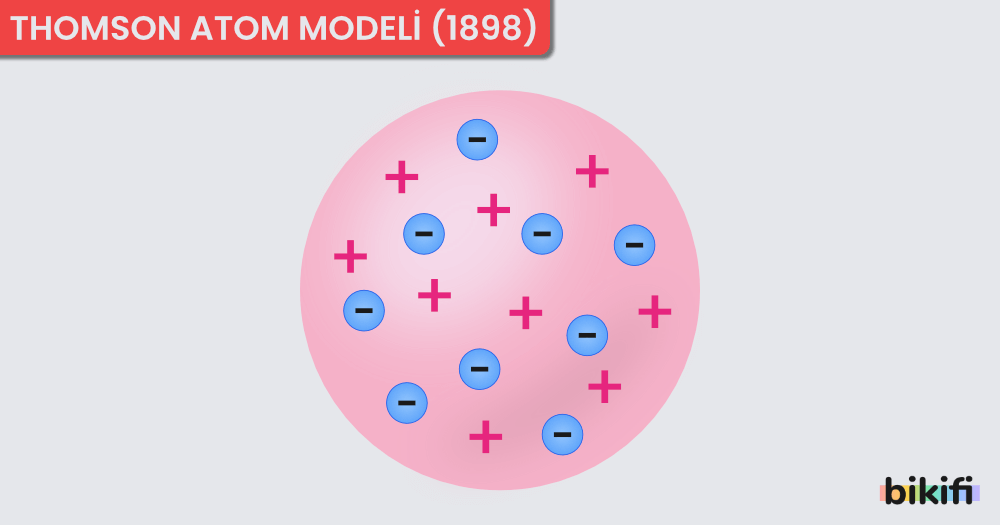
1900 lerin başında -Dalton’dan yaklaşık 100 yıl sonra- Joseph Thomson yeni bir atom teorisi geliştirdi. Atom yapısı ile ilgili çalışmalar, elektriğin yüklü taneciklerden oluştuğunu göstermiştir. Joseph John Thomson katot ışınları ile yaptığı deneylerde negatif yüklü taneciklerin yani elektronların varlığını saptamıştır. Elektronun varlığının belirlenmesinden sonra Dalton Atom Modeli yeni bir şekil almıştır. Atomlar yüksüz tanecikler olduklarına göre atom içinde (-) yüklü elektronları nötrleştirecek (+) yüklerin de bulunması gerekmektedir. Bu artı (+) yüklü taneciklere proton adı verilmiştir. J.J. Thomson’a göre;
- Bir atomda elektronların sayısı protonların sayısına eşittir. Bu nedenle atomlar yüksüzdür.
- Elektronların kütlesi, atomunkinden çok küçük olduğundan atomları başlıca artı yükler oluşturmuştur.
- Atom bir küre şeklindedir. Elektriksel dengeyi sağlamak için elektronlar ve protonlar küre içine dağılmışlardır.
Thomson atom modelini üzümlü keke benzetebiliriz. Kekin hamur kısmı pozitif yük, üzümler ise rastgele dağılmış negatif yüklerdir.
Thomson Atom Modelinin eksiklikleri:
- Elektronlar atom üzerinde rastgele dağılmamışlardır.
- Atomlar pozitif yüklü kürecikler değildir.
- Nötron hakkında bilgi verilmemiştir.
Thomson Atom Modeli ile Modern Atom Teorisi Karşılaştırması
| Thomson Atom Teorisi | Modern Atom Teorisi |
|---|---|
| Atomlar yaklaşık 10-10 m çapında içi dolu kürelerdir. | Atomlar yaklaşık 10-10 m çapında olan boşluklu yapılardır. |
| Küre içerisinde(atomda) artı yükler ve eksi yüklü elektronlar rastgele dağılmıştır. | Elektronlar rastgele değil belirli bir yörüngede hareket eder. |
| Atomda pozitif ve negatif yükler eşit sayıdadır. Bu sebeple atomlar yüksüzdür. | Elektronlar ve protonlar eşit sayıda olmayabilir. Bu sebeple atom yüklü olabilir. |
| Elektronların kütlesi atomun kütlesi yanında ihmal edilecek kadar küçüktür. Atomun kütlesi pozitif yüklerle oluşur. | Atomun içinde sadece elektron ve proton yoktur. |
Rutherford Atom Modeli
Rutherford, radyoaktif maddeden elde ettiği +2 yüklü alfa taneciklerini çok ince metal yaprak üzerine göndermiştir. Bu ışınların çok büyük bir kısmının sapmadan, az bir kısmının ise saparak metal yapraktan geçtiğini çok az bir kısmının ise geriye yansıdığını saptamıştır.

Rutherford, Thomson atom modeliyle bu sonuçları açıklayamamıştır. Atom homojen bir yapıda olsaydı, bütün α parçacıklarının levhayı geçmesi veya geçmemesi gerekirdi. α taneciklerinden bazılarının çok az sapması veya geri dönmesi, atom içinde (+) yüklü iyonların geçmesini zorlaştıran bir bölümün varlığını gösterdi. Bu nedenle Rutherford, atomda pozitif yükün ve kütlenin atom merkezinde çok küçük hacimde toplandığını düşündü ve bu bölüme çekirdek adını verdi. Deney sırasında sapan veya geri dönen a taneciklerinin çekirdeğe çok yakın gelen veya tam çekirdek üzerine isabet eden tanecikler olduğunu belirtti.

Bu modele göre;
- Atomun kütlesi ve artı yükler, atomun merkezinde çok küçük bir hacme toplanmıştır. (Rutherford bu merkeze atom çekirdeği adını vermiştir).
- Bir atomda çekirdekteki yükün sayısı, elektron sayısına eşittir.
- Çekirdekteki yük miktarı, bir elementin tüm atomlarında aynı, farklı elementlerin atomlarında farklıdır.
- Elektronların bulunduğu hacim, çekirdeğin hacminden çok büyüktür.
Rutherford atom modeli genellikle güneş sistemine benzetilebilir. Merkezde güneş yani çekirdek, etrafında belli bir yörüngede dönen gezegenler yani elektronlar vardır.
Rutherford Atom Modelinin eksiklikleri:
- Rutherford modeli atomdaki elektronların hareketlerini açıklayamadığı gibi elektronların niçin çekirdek üzerine düşmedikleri sorusunu da yanıtlayamamaktadır.
- Daha sonraki yıllarda Chadwick, atom çekirdeğinde nötron denilen yüksüz bir taneciğin varlığını saptamıştır. Bu şekilde, atomun üç temel tanecikten oluştuğu anlaşılmıştır.
Rutherford Atom Modeli ile Modern Atom Teorisi Karşılaştırması
| Rutherford Atom Teorisi | Modern Atom Teorisi |
|---|---|
| Atomda çekirdek adı verilen yapı vardır. | Atom kütlesinin büyük bir kısmı çekirdekten oluşur. |
| Atom, pozitif yüklü çekirdek ve onun çevresinde çembersel yörüngelerde dolanan negatif yüklü elektronlardan oluşur. Çekirden atomun kütlesinn çoğunluğunu oluşturur. | Atomun içinde çekirdek ve çekirdeğin etrafında elektronların bulunma ihtimalinin yüksel olduğu yerler vardır. |
| Atomun büyük kısmı boşluklu yapıdadır ve elektronlar çekirdek çevresindeki bu boşluklarda hareket etmektedir. | Atomun büyük kısmı boşluktan oluşur. |
| Eğer elektronlar durgun halde olsaydı çekirdekteki pozitif yükler ile elektronlar arasında oluşan elektrostatik çekimden dolayı elektronlar çekirdek üzerine düşerdi. | Elektron, çekirdek çevresinde belirli yörüngelerde çekirdeğe düşmeden hareket eder. |
Bohr Atom Modeli

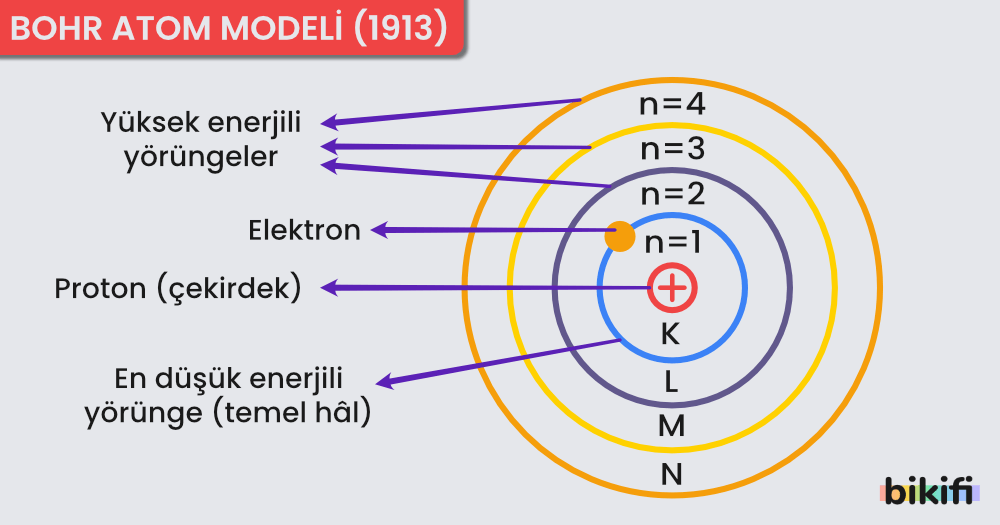
Rutherford atom modeli çekirdek çevresinde bulunan elektronların hareketlerini fizik yasalarına göre açıklamakta yetersiz kalmıştır. Bunun üzerine Danimarkalı Fizikçi Bohr bir elektronlu olan atom ya da iyonlar (1H, 2He+1, 3Li+2…) için bir atom modeli geliştirmiştir. Bohr atom modelinin varsayımları şunlardır:
- Elektronlar çekirdek çevresinde yarıçapı belli dairesel yörüngelerde bulunabilir. Bu yörüngelere enerji düzeyi de denir. Yörüngeler çekirdeğe yakınlık sırasına göre ya K, L, M… gibi harflerle, ya da 1, 2, 3, …n gibi tam sayılarla gösterilir. Her enerji düzeyinin belirli bir enerjisi vardır.
- Çekirdeğe en yakın enerji seviyesinin enerjisi en küçüktür. Çekirdekten uzaklaştıkça yörüngelerin enerjisi artar. Hidrojen atomunda bir elektron en düşük enerjili yörüngede bulunur. Bu yörüngelerden birinde bulunan elektron kendiliğinden enerji yaymaz. Elektronu olası en düşük enerjili yörüngelerde bulunan atomun elektron dizilişine temel hâl elektron dizilişi denir. Atom dışarıdan enerji kazanırsa elektron aldığı enerjinin değerine bağlı olarak daha yüksek enerjili bir düzeye sıçrar. Böyle elektronlara uyarılmış elektron, atomlara da uyarılmış atom denir.
En nihayetinde Bohr atom modelinin de eksiklikleri mevcuttur:
- Bohr atom modeli yalnızca tek elektronlu sistemlerin spektrumlarını açıklayabilir. Çok elektronlu sistemlerin spektrumları açıklamakta yetersiz kalır.
- Çok elektronlu atomların spektrumlarında enerji düzeylerinin her birinin iki ya da daha fazla düzeye ayrıldığı görülmektedir. Bu da Bohr’un teorisiyle açıklanamamaktadır.
Detayları Okuyun:Bohr Atom Modeliyle İlgili Detaylı Konu Anlatımı
Modern Atom Modeli (Kuantum Atom Teorisi)
Modern atom teorisi kabul görmeden önce şu gelişmeler gerçekleşmiştir;
- 1924 yılında W. Pauli elektronların değişik enerji seviyelerine (katman) dağılışları ve enerji seviyeleri arasındaki elektron geçişleri hakkında Pauli ilkesini ortaya koydu.
- 1932 yılında James Chadwick, çekirdek içindeki nötronları buldu.
- Heisenberg belirsizlik ilkesi kabul gördü. Bu ilkeye göre atomdaki elektronun yeri ve hızı, aynı anda, tam bir kesinlikle belirlenemez.
- E. Schrödinger kendi adıyla anılan denkleminde elektronların bulunma ihtimalinin yüksek olduğu uzay bölgelerini tespit etti.
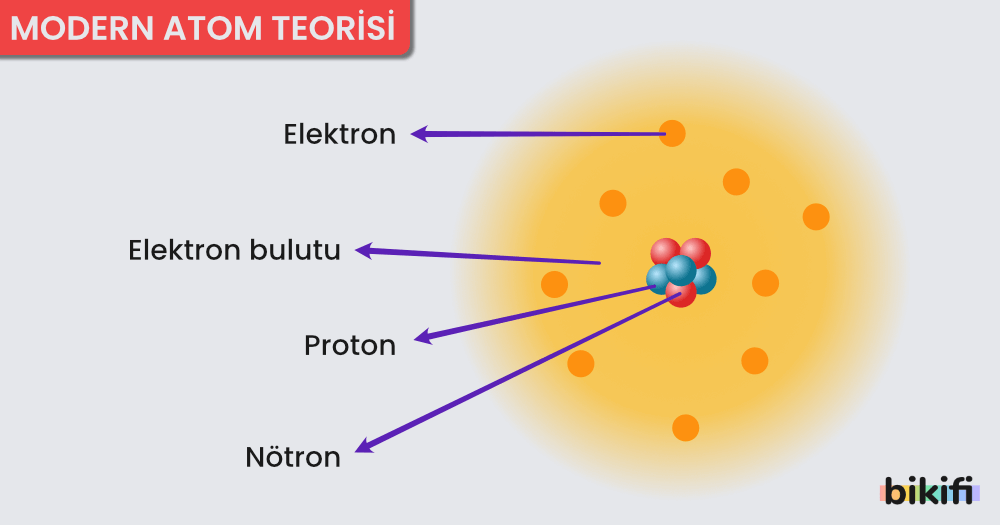
Tüm bu gelişmelerden sonra atom teorisi yeniden ele alınmış ve modern atom teorisi oluşmuştur. Bohr atom modeli, tek elektronlu türlerin davranışlarının açıklanmasında başarılı olmakla (örneğin hidrojen) birlikte çok elektronlu atomların davranışlarını açıklamada yetersiz kalmıştır. Modern atom teorisine göre Bohr atom teorisindeki gibi elektronları yörüngelerde sabit hızla dönen tanecikler olarak düşünmek yanlıştır. Modern atom teorisinin modelinin varsayımları şunlardır:
- Elektronlar çekirdek çevresinde belirli enerji düzeylerinde bulunur. Her enerji düzeyi “n” ile belirtilir. Bu enerji düzeylerine baş kuantum sayısı denir. Baş kuantum sayısı orbitallerin çekirdekten ortalama uzaklığını ya da enerjisini belirler. Çekirdekten uzaklaştıkça enerji artar. Çünkü protonların elektronları çekim gücü azalır, buna bağlı olarak da elektronların hareketi ve enerjisi artar.
- Elektronlar hem kendi çevrelerinde hem de çekirdek çevresinde döner. Elektronun kendi ekseni etrafında dönme hareketine spin hareketi, çekirdek çevresindeki dönme hareketine de orbital hareketi denir. Çekirdek çevresinde dönmeleri sırasında elektronların bulunma ihtimalinin yüksek olduğu geometrik bölgelere orbital denir.
- Herhangi bir temel enerji seviyesinde n² kadar orbital bulunur.
- Her temel enerji seviyesinde orbital sayısının 2 katı kadar elektron bulunabilir. Buna göre bir temel enerji seviyesindeki en fazla elektron sayısı 2n²
Benzer konu anlatımı: Atom ve Periyodik Sistem: Modelleme ve Bohr Atom Modeli
Atomun Kuantum Modelinin Gelişim Süreci
Einstein, fotoelektrik olayını açıklarken ışığın fotonlardan oluşan tanecikli bir yapıya sahip olduğunu düşünerek hareket etmişti. Ancak yapılan bir çok deney (kırılım ve girişim deneyleri) ışığın dalga özelliği taşıdığını göstermişti. Aynı dönemlerde Bohr atom modeli de açıklamakta yetersiz kaldığı konular üzerinde sorgulanmaktaydı.
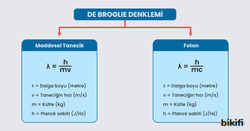
Yukarıdaki olayların temelinde yatan konu “ışık bir dalga mı yoksa tanecik mi” sorusudur. 1924 yılında De Broglie hipotezinde, ışık dalgalarının foton olarak davranabilmesinden yola çıkarak elektron gibi küçük taneciklerin dalga özelliği gösterebileceğini ileri sürdü.
De Broglie çalışmalarını daha çok elektronlar üzerine yoğunlaştırdı ve fotonun dalga boyunu hesaplamak için Einstein’ın formülüyle Planck’ın formülünü birleştirmiştir ve aşağıdaki formülleri üretmiştir.
De Broglie’nin çalışmaları ile Heisenberg’in ve Erwin Schrödinger’in çalışmaları sayesinde atomun kuantum modelinin gelişimi sağlanmıştır.