Evrende bulunan bütün maddeler tanecikli yapıdadır. Maddenin özelliğini gösteren en küçük yapı taşı olan bu tanecikler kimyasal tür olarak adlandırılır. 4 tane temel kimyasal tür vardır; atom, molekül, iyon ve radikal.
- Atom: Bir elementin tüm kimyasal özelliklerini gösteren yapı taşıdır. Atomları çok genel olarak, kararlı ya da kararsız atom olmak üzere 2 sınıfta inceleyebiliriz.
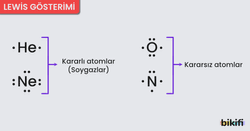
- Kararlı atomlar; yörüngelerinin son katmanında maksimum elektron taşıyan ve bağ yapmak isteği olmayan atomlardır.
- Kararsız atomlar; yörüngelerinin son katmanındaki elektronların sayısını arttırmak veya azaltmak suretiyle kararlı olmaya çalışan atomlardır.
- Molekül: Birden fazla kararsız atomun kararlı hale geçmek için bir araya gelerek oluşturdukları kimyasal türlerdir. Aynı tür atomlardan oluşan moleküller, element molekülüdür (ör; H2, O2, Cl2); farklı tür atomlardan oluşan moleküller ise bileşik molekülüdür (ör; CH4, NH4, NH3).
- İyon: Karasız atomların elektron alarak veya vererek oluşturdukları yapıya iyon denir. Elektron alan yapıya anyon iyonu, elektron veren yapıya katyon iyonu denir. Örneğin; Mg+2, F-1, SO4-2
- Radikal: Ortaklanmamış elektron bulunduran taneciklere radikal denir. Radikaller zincirleme reaksiyonlarda gözlemlenir. Genelde kararsız ara bileşikler oldukları için denklemlere yazılmazlar.
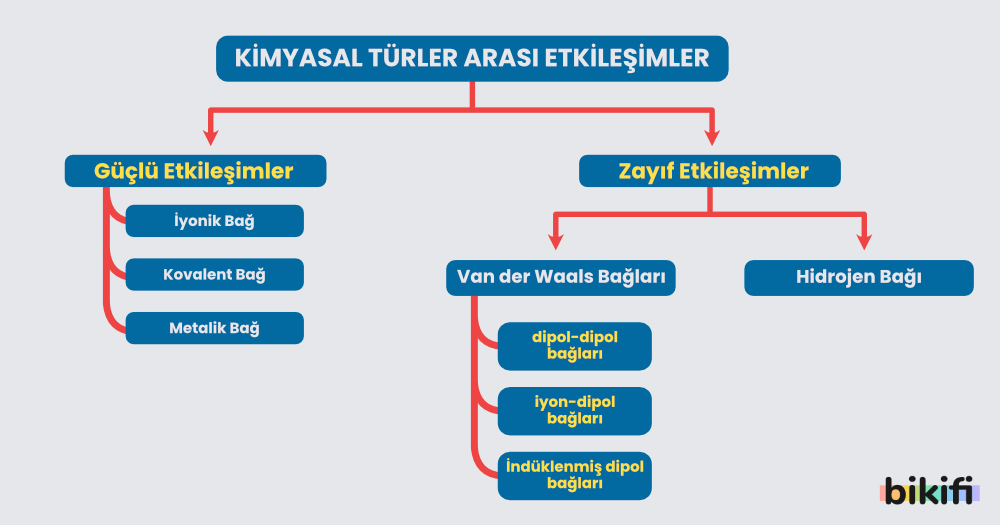
Kimyasal Türler Arası Etkileşimlerin Sınıflandırılması
Kimyasal türler arasında kimyasal bağlar aracılığıyla bir etkileşim olur. Örneğin bir molekül diğer molekülü kendisine çekebilir veya bir atom diğer bir atomla ortaklaşa elektron kullanarak yeni maddeler oluşturabilir.
Kimyasal bağları bozmak (ayırmak) için verilmesi gereken enerjiye bağ enerjisi denir. Bağ enerjisi 40 kJ/mol veya daha yüksek olan etkileşimlere güçlü etkileşimler, 40 kJ/mol’den daha düşük etkileşimlere zayıf (moleküller arası) etkileşimler denir.
Güçlü etkileşimlerin (metalik bağ hariç) kırılması sonucu kimyasal, zayıf etkileşimlerin kırılması sonucu fiziksel değişimler meydana gelir. Suyun donması veya buhar olması zayıf etkileşimlere; sodyum (Na) ve klor (Cl) atomlarının birleşerek sofra tuzunu (NaCl) oluşturması kuvvetli etkileşimlere örnektir.
Zayıf etkileşimler daha çok fiziksel bağlar olarak adlandırılır. Bir maddenin katı-sıvı gaz halinde olması zayıf etkileşimler sayesinde belirlenir.