📝 Konu Anlatımı: Atom kavramının tarihsel gelişimini ve diğer atom modelleri
Rutherford atom teorisi çekirdeğin üzerine düşmeden hareket eden elektronlar ve çekirdekte bir arada durabilen pozitif yükleri açıklayamamıştır. Neils Bohr bu problemi Max Planck ve Einstein’in teorilerini de kullanarak atomik boyutta geçerli olacak bir teori oluşturdu. Bohr, kendi teorisinde belirli yörüngelerden bahsetmiştir. Ayrıca teorisinde atom yarıçapı, enerji seviyeleri, uyarılma, iyonlaşma ve ışınlanma kavramlarını açıklamıştır.
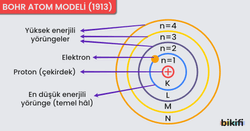
Rutherford atom teorisinde atom çevresinde dönen elektronlar sürekli ışıma yapmalıydı. Bohr, ışımaların sürekli olmadığını yörünge kavramı ile açıklamıştır. Atomlarda yörünge kavramını ilk Bohr kullandı. Elektronların çekirdekten uzaklaştıklarını, açısal momentumlarını, enerjilerini yörüngeler kavramı ile açıklamıştır. Bohr atom teorisinde elektronların hareketi iki hipotez ile anlatılabilir:
Neiels Bohr (1885-1962), Rutherford atom modelini temel alarak 1913 yılında Rutherford atım modelindeki güçlükleri gidermek için bit atom modeli ileri sürdü. Bohr bu moeli geliştirirken Planck’ın kuantum modeli, Einstein’in foton teorileri ve Newton mekaniğinden faydalanmıştır.
Bohr Atom Teorisinde Kararlı Yörünge
Elektronlar, pozitif yüklü çekirdek çevresinde Coulomb kuvvetinin etkisiyle ışıma yapmadan kararlı yörüngede hareket eder. Bohr, teorisi ile ilgili aşağıdaki temel varsayımlara ulaşmıştır.
- Elektronlar artı yüklü çekirdek çevresinde coulomb kuvvetinin çekme etkisi ile dairesel yörüngede ışıma yapmadan dolanırlar.
- Yalnızca bazı elektron yörüngeleri kararlıdır. Elektron bu kararlı yörüngelerde ışıma yapmaz. Bu durumda atomun enerjisi sabit kalacağından, elektronun hareketi klasik mekanikle açıklanabilir. Bu durumda elektrona etki eden merkezcil kuvvet elektrostatik kuvvettir.
- Yörüngede dolanan bir elektronun açısal momentumunu
şeklinde ifade etmiştir.
- Burada L açısal momentum, h planck sabiti, n ise elektronun dolandığı yörünge numarasıdır.
- Yörüngede dolanan bir elektronun açısal momentumunu
- Bir elektron yüksek enerjili kararlı bir yörüngeden düşük enerjili kararlı bir yörüngeye kendiliğinden geçebilir. Bu geçiş sırasında atomdan bitr foton yay�ılır. Yayılan fotonun frekansı elektronun ilk ve son yörüngeleri arasındaki enerji farkıyla belirlenir.
Elektronların Bulunabileceği Yörünge Yarı Çapları
Bohr atomu +Ze yüklü bir çekirdek ve bu çekirdek çevresinde r yarıçaplı bir çember üzerinde dolanan -e yüklü bir elektrondan ibarettir. Elektronu yörüngede tutan kuvvetler şunlardır:
- Merkezcil kuvvet
- Çekirdek ile elektron arasındaki Coulomb çekim kuvveti
Kütlesi m, hızı v ve yörünge yarıçapı r olan elektona etkiyen merkerkezcil kuvvet, ve coulomb çekim kuvveti ise, dir.
Açısal momentum, dir.
Bu bağıntılardan faydalanarak n. yörüngede dönen bir elektronun çizgisel hızı ve bu yörüngenin yarıçapı hesaplanabilir.
Burada r elektronun dolanma yarıçapı, Z atom numarası, n yörünge numarasıdır. Burada sabitine Bohr yarıçapı denir ve 0,529 ≅5,29 Å ‘dur.
Bohr Yörüngelerinde Elektronun Enerjileri
v hızı ile çekirdek çeresinde yarıçaplı yörüngede dolanan bir elektronun elektrik potansiyel enerjisi= dir. Kinetik enerjisi= dir. Elektonun toplam enerjisi(E) bu iki denkliğin toplamıdır ve
şeklinde ifade edilir. Burada E toplam enerji, Z atom numarası, n yörünge numarasıdır. Formüldeki eksi(-) işareti elektronun üst yörüngelere çıktıkça toplam enerjisinin sıfıra yaklaşarak arttığını ve sıfır olunca elektronun atomdan koptuğunu gösterir.
n yörünge numarası arttıkça
- Elektronların açısal momentumu artar.
- Elektronların yörünge yarıçağı artar.
- Elektronların toplam enerjisi artar(sıfıra yaklaşır).
- Elektronlar çekirdekten uzaklaştıkça çekirdeğe bağlılıkları azalacağından elektronların çizgisel momentumu ve hızı azalır.
Hidrojen Atomunun Spektrumu
Elektronlar, üst enerji seviyesinden herhangi bir alt enerji seviyesine geçiş yaptığında iki enerji seviyesi arasındaki enerji farkına eşit enerjiye sahip bir foton yayınlar. Atomun foton yoluyla enerjisini dışarıya atmasına ışıma denir. Hidrojen atomu kızılötesi, morötesi ve görünür ışık dalga boyunda ışıma yapabilir.
Bir enerji seviyesinden başka enerji seviyesine geçen elektron f frekanslı ve λ dalga boylu bir foton yayınlar ve fotonun enerjisi
bağıntısı ile bulunur. Burada c ışık hızı, h Planck sabitidir.(Adını Max Planck’tan alan sabitin yaklaşık değeri j.s ‘dir. )
Enerji seviyesi arası fark ne kadar artarsa fotonun frekansı artar ve dalga boyu o kadar küçülür.
Bohr Atom Modelinde Uyarılma
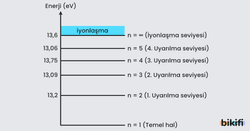
Temel halde bulunan atoma dışarıdan enerji verilmesi sonucu atom uyarılabilir. Elektronu üst seviyeye çıkmış atoma uyarılmış atom denir. Elektronu bir üst enerji seviyesine çıkarmak için gereken enerjiye uyarılma enerjisi denir. Uyarılmış bu elektron temel düzeye dönerken ışıma yapar. Uyarılmış hidrojen atomlarının yüksek enerji seviyesindeki yörüngeden düşük enerji seviyesindeki yörüngeye geçişinde yaptıkları ışımalara spektrum çizgileri denir. Elektronun atomdan koparılarak serbest hale getirilmesi olayına iyonlaşma denir. İyonlaşan atomun elektronu serbest parçacık gibi davranır. Temel haldeki bir atomdan elektron kaparmak için gerekli en küçük enerjiye iyonlaşma enerjisi denir.
Hidrojen atomunun temel hal enerjisi -13,6 eV ‘tur. Yaani çekirdekten elektronu koparmak için atoma +13,6 eV enerji vermek gerekir ki aynı zamanda bu enerji hidrojenin iyonlaşma enerjisidir. Enerji seviyelerinin temel hal ile enerji farkı hidrojen atomunun uyarılma enerji seviyelerini gösterir. Örneğin 1. uyarılma seviyesi için enerji eV.
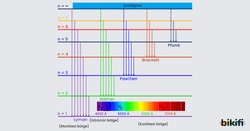
Hidrojen atomunun uyarılması sonucu bilim insanları spectrum çizgilerini keşfetmiştir ve bu spektrumlar kendi isimleriyle anılmaktadır. Hidrojen atomundaki elektronların enerji seviyeleri arasındaki bazı spektrum çizgileri aşağıdaki gibidir.
- Lyman Serisi: Yüksel enerji seviyelerinden temel hale(n=1) olan geçişlerdir ve ışımanın dalga boyu morötesi bölgededir.
- Balmer serisi: Yüksek enerji seviyelerinden n=2 enerji seviyesine yani 1. uyarılma seviyesine yapılan geçişlerdir ve ışımanın dalga boyu kızılötesi dalgalarına denk gelir.
- Paschen Serisi: Yüksek enerji seviyelerinden n=3 enerji seviyesine yani 2. uyarılma seviyesine yapılan geçişlerdir ve ışımanın dalga boyu kızılötesi dalgalarına karşılık gelir.
Bohr Atom Teorisi Özet
Atomla bağlantılı olan kuantum ve yörünge kavramlarını ilk kullanan Bohr atomda enerjinin sürekli olmadığını, kesikli olduğunu yani her değeri alamayacağını belirtmiştir. Teorileri modern fiziğe geçişte öncü olmuştur.
Bohr çalışmaları tek elektronu olan atomlarda başarılı olmuştur ve günümüzde de bu atomlarda geçerlidir fakat Bohr atom teorisi ile açıklanamayan durumlar vardır:
- Bohr, birden çok elektronun bulunduğu atomları açıklamakta yetersiz kalmıştır.
- Spektruma ait çizgiler tek elektronlu atomlar için incelenmişken çok elektronlularda incelenememiştir.
- Atomlarda bazı çizgilerin daha parlak görülmesi bazı geçişlerin daha çok tercih edildiğini gösteriyordu fakat sprektrum çizgilerinde gözlenen parlaklık farkını açıklamakta yetersiz kalmıştır.