Atomun kuantum modeli, günümüzdeki atom anlayışını yansıtan bir modellemedir. Bu modellemeye göre elektronların konumu ve vektörel hızı birbirini bütünleyen ögelerdir. Bundan dolayı birisini kesin olarak saptadığımız zaman diğeri belirsiz hale gelir. Yani bir elektronun kesin olarak konumu ve hızı aynı anda bilinememektedir. Atomun kuantum modeline göre; elektronların çekirdek etrafında bulunma olasılığının en yüksek olduğu bölgeye orbital denir.
Elektronların dağılımı, bulundukları enerji düzeyinin türü ve sayısı ile belirlenir. O halde elektronların atomda çekirdek etrafında hangi enerji düzeyinde bulunduğunu belirlemek için kuantum sayılarını bilmek gerekir. Bunlar sırasıyla aşağıdaki gibidir;
- Baş kuantum sayısı (n),
- Açısal momentum (ikincil) kuantum sayısı (l),
- Manyetik kuantum sayısı (m),
- Spin kuantum sayısı (s)
Orbital
Avusturalyalı fizikçi Schrödinger’e göre orbital tanımı şöyledir:
“Atomda enerji düzeyleri ve dalga fonksiyonları, kuantum sayıları ile ifade edilir ve kuantum mekaniğinde, yörünge kavramı olarak orbital tanımı kullanılır.”
Baş Kuantum Sayısı (n)

Baş kuantum sayısı elektronun bulunduğu ana enerji düzeyini gösterir. “n” ile gösterilir. 1, 2, 3, 4 gibi tam sayı değerlerini alabilir. Elektronun çekirdeğe olan uzaklığı ile ilgilidir. Baş kuantum sayısı ne kadar küçükse elektron çekirdeğe o kadar yakındır. Örneğin, bir elektron için n=2 ise bu elektron 2. temel enerji düzeyindedir.
Ayrıca baş kuantum sayıları yerine, “K (n=1), L (n=2), M (n=3), N (n=4), O (n=5)” olarak isimlendirilen kabuk isimleri de kullanılabilir.
Açısal Kuantum Sayısı (l)
Açısal momentum kuantum sayısı (l), elektron bulutlarının şekillerini ve şekil farkı nedeniyle oluşan enerji seviyelerindeki değişmeleri belirtmekte kullanılır. Açısal momentum kuantum sayısı “l” ile gösterilir. n’ye bağlı olarak sıfırdan n-1’e kadar bütün tam sayı değerlerini alabilir
Örneğin, n = 3 ise l = 0, 1, 2 değerlerini alır.
Ana enerji düzeyleri, yapıları birbirinden farklı alt enerji düzeyleri içerir. Meydana gelen bu enerji seviyelerine ikincil katman denir. İkincil katmanlar s, p, d, f gibi harflerle (orbital sembolleriyle) gösterilir [s = sharp (keskin), p = principal (asıl, baş), d = diffuse (yayılmış), f = fundamental (temel)]. Bu harfler, l’nin her bir sayısal değerine karşılıktır.
| (1) | 0 | 1 | 2 | 3 |
|---|---|---|---|---|
| Orbitalin Sembölü | s | p | d | f |
Manyetik Kuantum Sayısı (ml)
Atomdaki alt enerji düzeyleri manyetik alan etkisiyle birbirinden farklı orbitallere ayrılır. Manyetik kuantum sayısı manyetik alan etkisiyle kalan orbitallerin uzaydaki yönelim biçimleri ve alt enerji düzeylerinde kaç orbital bulunduğunu gösterir.
Manyetik kuantum sayısı ml ile gösterilir. Değeri, açısal momentum kuantum sayısının değerine bağlıdır. Verilen l değeri için ml değeri 2l+1 kadar farklı değer alır. Bu değerler “–l , 0 , +l “arasındaki tam sayı değerleridir.
| n | 1 | m | orbital |
|---|---|---|---|
| 1 | 0 | 0 | 1s |
| 2 | 0 | 0 | 2s |
| 2 | 1 | +1, 0, -1 | 2p |
| 3 | 0 | 0 | 3s |
| 3 | 1 | +1, 0, -1 | 3p |
| 3 | 2 | +2, +1, 0, -1, -2 | 3d |
| 4 | 0 | 0 | 4s |
| 4 | 1 | +1, 0, -1 | 4p |
| 4 | 2 | +2, +1, 0, -1, -2 | 4d |
| 4 | 3 | +3, +2, +1, 0, -1, -2, -3 | 4f |
Spin Kuantum Sayısı (s)
Elektron çekirdek çevresinde dönerken aynı zamanda kendi etrafında da döner. Elektron kendi çevresindeki dönme hareketine spin hareketi denir. Bu spin hareketi sırasında elektron bir magnetik alan meydana getirir. Bu alanda elektronun davranışını manyetik spin kuantum sayısı belirler. “s” ile gösterilir. Spin manyetik kuantum sayısı ancak (1/2) ve (-1/2) değerini alır. Bu durum her orbitalde en fazla 2 elektronun bulunabileceğini ve bu elektronların spinlerinin ters olduğunu gösterir.
Yörüngeler (Orbitaller)
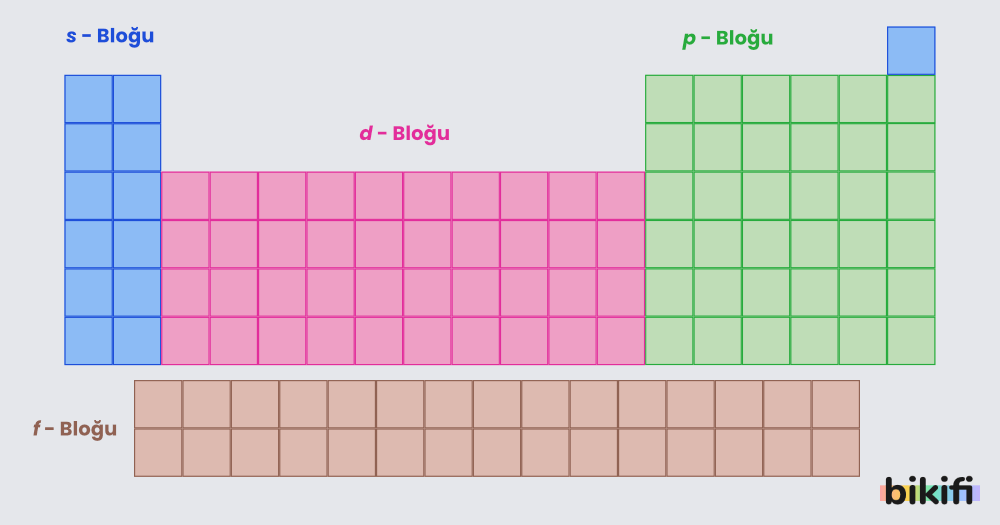
Elektronların çekirdek etrafında bulunma olasılığının en yüksek olduğu bölgeye orbital denir. Açısal momentum kuantum sayısına (l) bağlı olarak s, p, d ve f orbitalleri olmak üzere dört çeşit orbital vardır.
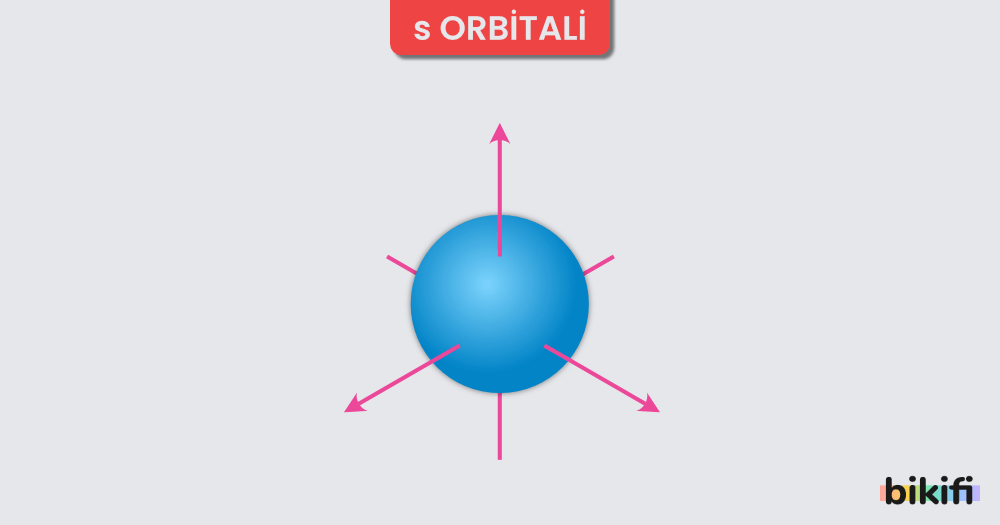
s Orbitali
Küre şeklindedirler. Çekirdekten uzaklaştıkça yoğunluğu azalır. Baş kuantum sayısının değeri büyüdükçe s orbitallerinin enerjisi artar. s orbitalleri en fazla iki elektron bulundurabilirler.
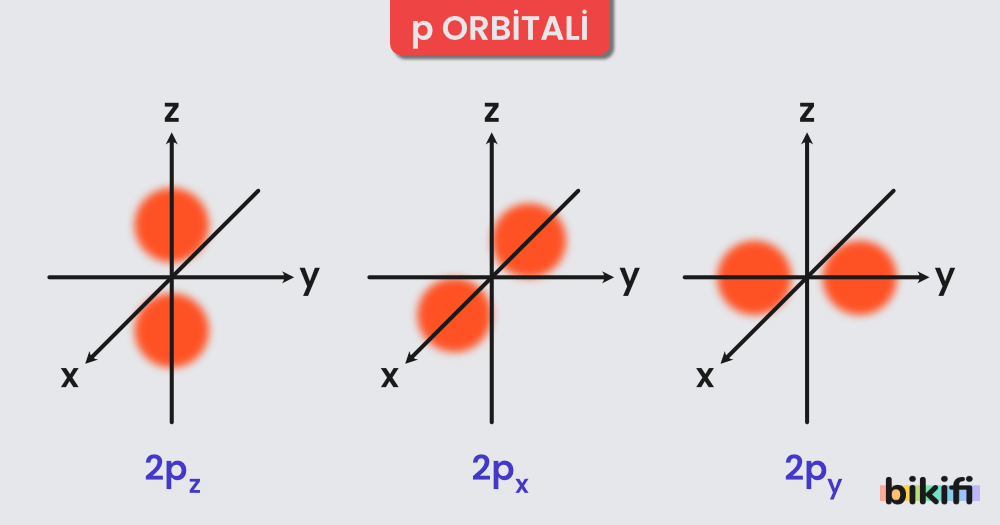
p Orbitali
p orbitalleri çekirdeğin iki tarafında zıt olarak yerleşmişlerdir. Kum torbasına benzeyen p orbitalleri üç orbitalden oluşur ve bu üç orbitalin enerjileri birbirine eşittir (px, py ve pz orbitalleri). En çok 6 elektron alır. İkincil kuantum sayısı l’nin 1 değerine karşılık gelir. Bir p orbitali hiç bir zaman çekirdekte bulunmaz, ikinci ve daha üst enerji seviyelerinde bulunmaktadır.
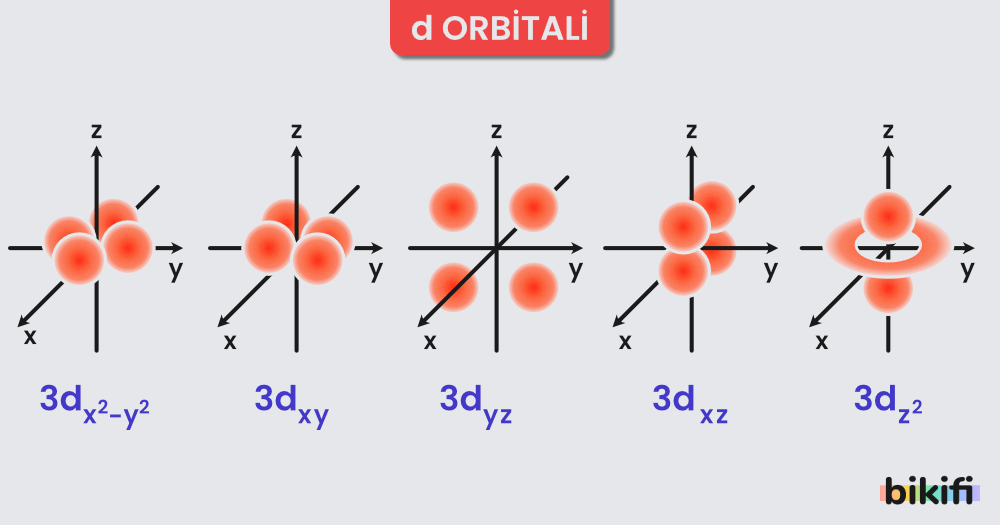
d Orbitali
Üçüncü ve daha üst enerji seviyelerinde bulunurlar. Dış manyetik alan yokken aynı enerji seviyesinde 5 tane ayrı d orbitali bulunur. En çok 10 elektron alır. l’nin 2 değerine karşılık gelir. s ve p orbitallerine göre daha karmaşık bir yapısı vardır.
f Orbitali
Dördüncü veya daha üst enerji düzeylerinde bulunur. 7 orbitalden oluşur ve en çok 14 elektron alır. İkincil kuantum sayısı l’nin 3 değerine karşılık gelir.
Orbitallere Elektron Dağılımı
Atom numarası bilinen bir atomun, elektron dağılımını gösteren şemaya atomun orbital şeması denir.

Elektronlar orbitallere dağılırken belli kurallar altında dağılırlar. Bu kuralları şöyle sıralayabiliriz:
- Çekirdeğe en yakın olan en düşük enerjili orbitalden başlanarak sıra ile en yüksek enerjili orbitale doğru doldurulur (Aufbau kuralı).
- Her orbital en fazla iki elektron alır. Bu elektronların spinleri (dönme yönleri) zıttır (Pauli kuralı).
- Eş enerjili orbitallere, önce elektronlar birer birer yerleştirilir. Sonra her bir orbitaldeki elektron sayısı ikiye tamamlanır (Hund kuralı).
Çok elektronlu atomlarda, elektronların orbitallere dağılışı farklılık gösterebilir. Bunu daha iyi anlamak için aşağıda verilen tabloyu inceleyelim.

Elektronların orbitallere yerleşimindeki sıra, spektroskobik ve manyetik yöntemlerle ortaya konulmuştur. Bunun sonucunda yukarıdaki elektron yerleşim sırası kurgulanmıştır.
“1s-2s-2p-3s-3p-4s-3d-4p-5s-4d-5p-6s-4f-5d-6p-7s-5f-6d-7p-8s” şeklinde sıralanmıştır.
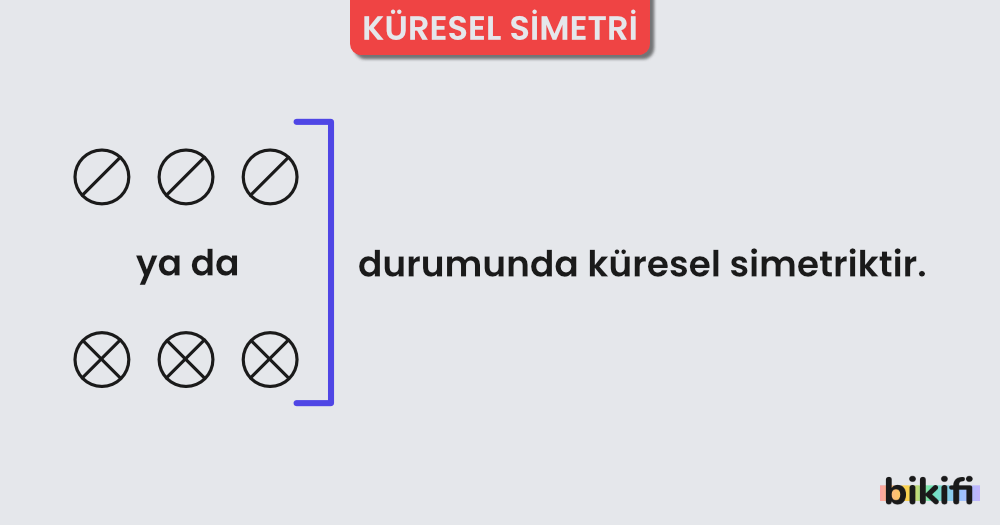
Küresel Simetri
Eş enerjili orbitallerin yarı dolu veya tam dolu olması atoma küresel simetri özelliği kazandırır. Eş enerjili orbitallerin yarı dolu veya tam dolu olması durumunda elektronlar çekirdek tarafından daha kuvvetli çekildiğinden çekirdeğe yaklaşır ve atom çapı küçülür. Bu durum atoma kararlılık kazandırır. Örneğin; s orbitalinde 1 veya 2, p orbitalinde 3 veya 6, d orbitalinde 5 veya 10, f orbitalinde 7 veya 14 elektron bulunması atoma küresel simetrik yapı kazandırır.
Bazı İyonların Örnek Orbital Dağılımları
İyonların elektronları orbitallere yerleştirilirken, öncelikle en az enerjili orbital doldurulmaya başlanır (Aufbau ilkesi).
Aşağıdaki görselde karbon (C), azot (N), oksijen (O), flor (F), Neon (Ne) ve Sodyum (Na) elementlerinin orbital dağılımlarını bulabilirsiniz.














