Var olan ve bilinen kaynaklardan hareketle bilinmeyen bir hedefi basit ve anlaşılır hale getirmek için yapılan işlemler bütününe modelleme denir. Modellemeye daha çok soyut, duyu organlarımızın yetersiz kaldığı veya zihinde canlandırılmasını istediğimiz olaylarda kullanırız. Bilimsel modelleme sayesinde bir konu daha hızlı öğrenilebilir veya gösterilebilir.
Bilim insanları atomları daha iyi anlamak için atom modelleri yaparak atomu görselleştirmeye çalışmışlardır. Ancak bu modellemeler doğrudan doğruya gözlem yaparak oluşturulmamıştır. Bu yüzden atom modellerinin eksik veya hatalı olduğu yönler mevcuttur.
- Dalton Atom Modeli
- Thomson Atom Modeli
- Rutherford Atom Modeli
- Bohr Atom Modeli
- Modern Atom Modeli
Dalton Atom Modeli (1808)
Dalton zamanında kabul gören atom teorisi, kimyanın temel kanunlarından birisi olan sabit oranlar kanununu açıklamakta yetersiz kalıyordu. Dalton, atom kavramını sabit oranlar kanunu açıklayacak şekilde yeniden açıklamıştır. Bu atom modeline göre:
- Her element, atom adı verilen çok küçük ve bölünemeyen taneciklerden oluşmuştur.
- Elementi oluşturan bütün atomlar aynı boyutta, kütlede ve diğer her yönden aynıdır.
Dalton, kendi oluşturduğu atom modelinden yararlanarak “Katlı Oranlar Kanunu” ortaya atmıştır. Ayrıca dalton atom modeli sabit oranlar ve kütlenin korunumu kanunu açıklayabilmiştir.
Dalton, atom modelinde; atomun boşluklu yapısı, izotop atom kavramı ve atom yapısındaki elektriksel yapı açıklanamamıştır.
Thomson Atom Modeli (1898)
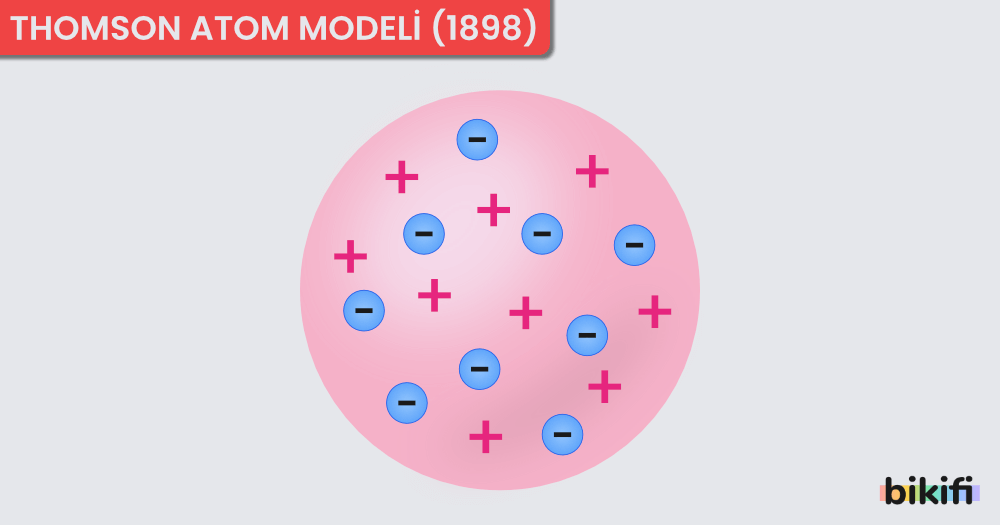
Thomson yapmış olduğu çalışmalar sonucunda atomun içindeki negatif yüklere sahip elektronları bulmuştur. Daha sonraki çalışmalarıyla birlikte atomun yüksüz bir tanecik olduğunu ispatlamış ve buradan da atomun yüksüz olmasını sağlayan pozitif yüklü taneciklerin var olması gerektiği sonucunu çıkarmıştır. Bu buluşlarını katot ışınları sayesinde keşfetmiştir. Thomson’ın oluşturduğu atom modeline göre;
- Atom, üzümlü keke benzemektedir. Üzümler elektronlar gibi kekin içinde rastgele dağılmıştır.
- Bir atomda elektronların sayısı protonların sayısına eşittir. Bu nedenle atom yüksüzdür.
- Elektronlar çok küçük ve hafiftir, atoma ağırlığını veren protonlardır.
Thomson, atom modelinde; nötronun varlığını gösterememiş ve proton ve elektronların atom içindeki konumunu doğru tespit edememiştir.
Rutherford Atom Modeli (1911)

Rutherford, deneylerinde alfa ışınlarını kullanmıştır. Kurduğu düzenekte alfa ışınlarının sapmasını ölçmüş ve çok az miktardaki alfa ışınının saptığını gözlemlemiştir. Buna göre atom modeli;
- Atomun büyük bir kısmı boşluktur.
- Atomun (kütlece) büyük bir kısmı çekirdek denen, atoma kıyasla hacimce çok küçük bir bölgede toplanmıştır.
- Elektronların bulunduğu hacim çekirdeğin hacminden çok büyüktür.
- Atomun ağırlığının yaklaşık yarısı protonlar tarafından oluşturulmaktadır.
Rutherford, atom modelinde; elektronların çekirdek etrafında nasıl dağıldığını açıklayamamış ve nötronun varlığını ifade etmiş ancak kanıtlayamamıştır.
Bohr Atom Modeli (1913)
Bohr tarafından 1913 yılında, Rutherford atom modelinden yararlanılarak öne sürülmüştür. Bohr atom modeli, Rutherford atom modelinin açıklayamadığı “elektronların çekirdek etrafındaki dağılımı” açıklamıştır.

Bohr Atom Modeli
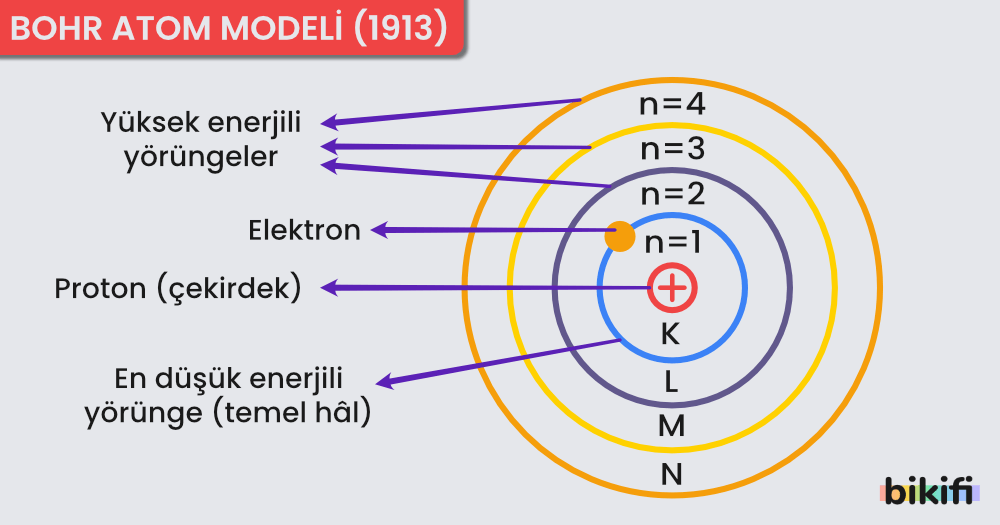
- Atomdaki elektronlar, çekirdekten belirli bir uzaklıkta yörüngeler halinde bulunur ve her yörüngenin kendisine ait bir enerjisi vardır.
- Elektronlar yörünge değiştirdiklerinde, yörüngeler arasındaki enerji farkı kadar ışıma yapar veya soğurur.
- Elektronlar en küçük enerji düzeyinde (temel düzey) bulunmak ister. Madde ısıtıldığında elektronlar daha yüksek enerji düzeyine geçer. Bu durumdaki atomlar uyarılmış haldedir.
- Çekirdeğin etrafında çekirdekten uzaklaştıkça enerjisi artan 7 enerji düzeyi vardır. En düşük enerji düzeyi 1 olmak üzere enerji düzeyleri tam sayı ile numaralanır. Yörüngeler K, L, M, N, O, P, Q harfleri ile veya 1, 2, 3, 4, 5, 6, 7 gibi rakamlar ile gösterilebilir.
Bohr Atom Modelindeki Eksiklikler
- Bohr atom modelindeki kazanımlar (formüller) sadece tek elektrona sahip hidrojen atomunda uygulanabilmektedir.
- Yörünge kavramı elektronların davranışları için yetersiz bir kavramdır.
- Nötronlardan hiç bahsetmemiştir.
- Elektronun ikili (dalga-parçacık) karakterini hesaba katmamıştır.
Modern Atom Teorisi
- 1924 yılında W. Pauli elektronların değişik enerji seviyelerine (katman) dağılışları ve enerji seviyeleri arasındaki elektron geçişleri hakkında Pauli ilkesini ortaya koydu.
- 1932 yılında James Chadwick, çekirdek içindeki nötronları buldu.
- Heisenberg belirsizlik ilkesi kabul gördü. Bu ilkeye göre atomdaki elektronun yeri ve hızı, aynı anda, tam bir kesinlikle belirlenemez.
- E. Schrödinger kendi adıyla anılan denkleminde elektronların bulunma ihtimalinin yüksek olduğu uzay bölgelerini tespit etti.
Tüm bu gelişmelerden sonra atom teorisi yeniden ele alınmış ve modern atom teorisi oluşmuştur. Bu teoriye göre;
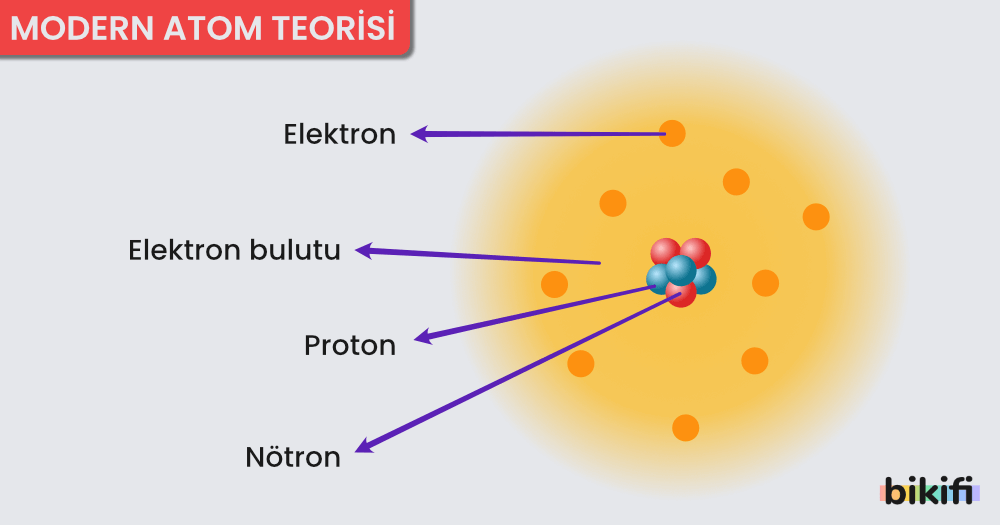
- Elektron için belirli bir yörüngeden değil, elektronun bulunma olasılığının yüksek olduğu bölgelerden bahsedilir. Katman ve orbital kavramları kullanılır.
- Atom çekirdeği etrafındaki her temel enerji düzeyi (katman), belirli sayıda orbital denilen alt enerji düzeylerinden (alt katman) oluşmuştur.
- Herhangi bir temel enerji seviyesinde n² kadar orbital bulunur.
- Her temel enerji seviyesinde orbital sayısının 2 katı kadar elektron bulunabilir. Buna göre bir temel enerji seviyesindeki en fazla elektron sayısı 2n²
Detaylı konu anlatımı: Modern Atom Teorisi













