Güncel

Kimyasal Etkileşimler: Giriş ve Etkileşimlerin Sınıflandırılması
Ders Notuna git →
Güncel

Kimyasal Etkileşimler: Güçlü Etkileşimler
Ders Notuna git →
Güncel

Kimyasal Etkileşimler: Zayıf Etkileşimler
Ders Notuna git →
Güncel

Kimyasal Etkileşimler: Fiziksel ve Kimyasal Değişimler
Ders Notuna git →
✍ PDF Çalışma Kaynakları
📘 Kurum: MEB – OGM Materyal
🔗 İndirme Linki: PDF Linki
📘 Kurum: MEB – OGM Materyal
🔗 İndirme Linki: PDF Linki
📘 Kurum: MEB – OGM Materyal
🔗 İndirme Linki: PDF Linki
📝 Ünite Kazanımları
- 9.3.1. Kimyasal Tür
- 9.3.1.1. Kimyasal türleri açıklar. Radikal kavramına girilmez.
- 9.3.2. Kimyasal Türler Arası Etkileşimlerin Sınıflandırılması
- 9.3.2.1. Kimyasal türler arasındaki etkileşimleri sınıflandırır.
- a. Bağlanan türler arası sınıflandırma, atomlar arası ve moleküller arası şeklinde yapılır; bu sınıflandırmanın getirdiği güçlüklerle değinilir.
- b. Güçlü etkileşimlere örnek olarak iyonik, kovalent ve metalik bağ; zayıf etkileşimlere örnek olarak da hidrojen bağı ve van der Waals kuvvetleri verilir.
- 9.3.2.1. Kimyasal türler arasındaki etkileşimleri sınıflandırır.
- 9.3.3. Güçlü Etkileşimler
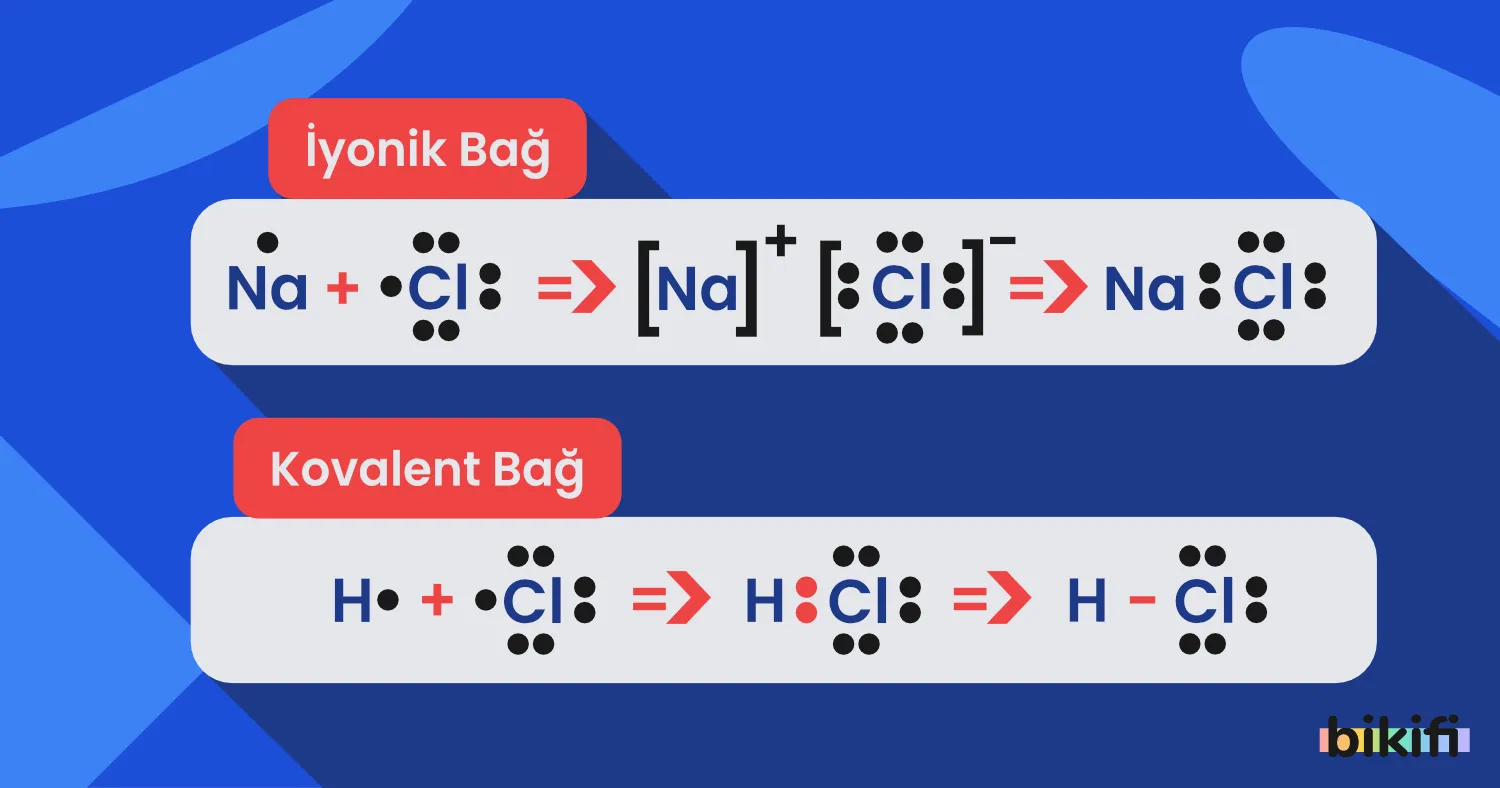
- 9.3.3.1. İyonik bağın oluşumunu iyonlar arası etkileşimler ile ilişkilendirir.
- a. Nötr atomların ve tek atomlu iyonların Lewis sembolleri verilir. Örnekler periyodik sistemdeki ilk 20 element arasından seçilir.
- b. İyonik bileşiklerin yapısal birimleri ile molekül kavramının karıştırılmamasına vurgu yapılır.
- 9.3.3.2. İyonik bağlı bileşiklerin sistematik adlandırmasını yapar.
- a. Tek atomlu ve çok atomlu iyonların (NH₄⁺, OH⁻, NO₃⁻, SO₄²⁻, CO₃²⁻, PO₄³⁻, CN⁻, CH₃COO⁻) oluşturduğu bileşiklerin adlandırılması yapılır.
- b. Değişken değerlikli metallerin (Cu, Fe, Hg, Sn, Pb) oluşturduğu bileşiklerin adlandırılması yapılır.
- c. Hidrati bileşiklerinin adlandırılmasına girilmez.
- 9.3.3.3. Kovalent bağın oluşumunu atomlar arası elektron ortaklaşması temelinde açıklar.
- a. Kovalent bağlar sınıflandırılırken polar ve apolar kovalent bağlar verilir; kovalent bağa girilmez.
- b. Basit moleküllerin (H₂, Cl₂, O₂, N₂, HCl, H₂O, BH₃, NH₃, CH₄, CO₂) Lewis elektron nokta formülleri verilir ve moleküllerin polar/ apolarlık durumları üzerinde durulur.
- c. Kovalent bağların açıklanmasında bilişim teknolojilerinden (animasyon, simülasyon, video vb.) yararlanılır.
- 9.3.3.4. Kovalent bağlı bileşiklerin sistematik adlandırılmasını yapar. H₂O, HCl, H₂SO₄, HNO₃, NH₃ bileşik örneklerinin sistematik adları verilir.
- 9.3.3.5. Metalik bağın oluşumunu açıklar. Metalik bağın açıklanmasında elektron denizi modeli kullanılır.
- 9.3.3.1. İyonik bağın oluşumunu iyonlar arası etkileşimler ile ilişkilendirir.
- 9.3.4. Zayıf Etkileşimler
- 9.3.4.1. Zayıf ve güçlü etkileşimleri bağ enerjisi esasına göre ayırt eder.
- 9.3.4.2. Kimyasal türler arasındaki zayıf etkileşimleri sınıflandırır.
- a. Van der Waals kuvvetleri (dipol-dipol etkileşimleri, iyon-dipol etkileşimleri, dipol-indüklenmiş dipol etkileşimleri, iyon-indüklenmiş dipol etkileşimleri ve London kuvvetleri) açıklanır.
- b. Dipol-dipol etkileşimleri, iyon-dipol etkileşimleri ve London kuvvetlerinin genel etkileşime güçleri karşılaştırılır.
- 9.3.4.3. Hidrojen bağları ile maddelerin fiziksel özellikleri arasında ilişki kurar.
- a. Hidrojen bağının oluşumu açıklanır.
- b. Uygun bileşik serilerinin kaynama noktası değerleri grafik üzerinde verilir; hidrojen bağları ve diğer etkileşimler karşılaştırılarak açıklanır.
- c. Aziz Sancar’ın DNA’nın onarımı ile ilgili çalışmalarına ve kısa biyografisine okuma parçası olarak yer verilir. Sabırlı, azimli ve kararlı olmanın bilimsel çalışmalarda başarıya ulaşmadaki önemi vurgulanır.
- 9.3.5. Fiziksel ve Kimyasal Değişimler
- 9.3.5.1. Fiziksel ve kimyasal değişimi, kopan ve oluşan bağ enerjilerinin büyüklüğü temelinde ayırt eder. Türler arasında fiziksel ve kimyasal değişimlerin açıklanmasında bilişim teknolojilerinden (animasyon, simülasyon, video vb.) yararlanılır.