Periyodik cetvel, elementlerin artan proton sayısına göre oluşturuldukları, yapısı sayesinde bir takım teknik bilgileri sadece konumuna bakarak anlayabileceğimiz bir şemadır. Periyodik cetvele, modern atom teorisinde öğrendiğimiz kuantum bilgileriyle yaklaşınca periyodik cetvelin yapısı daha iyi anlaşılmaktadır.
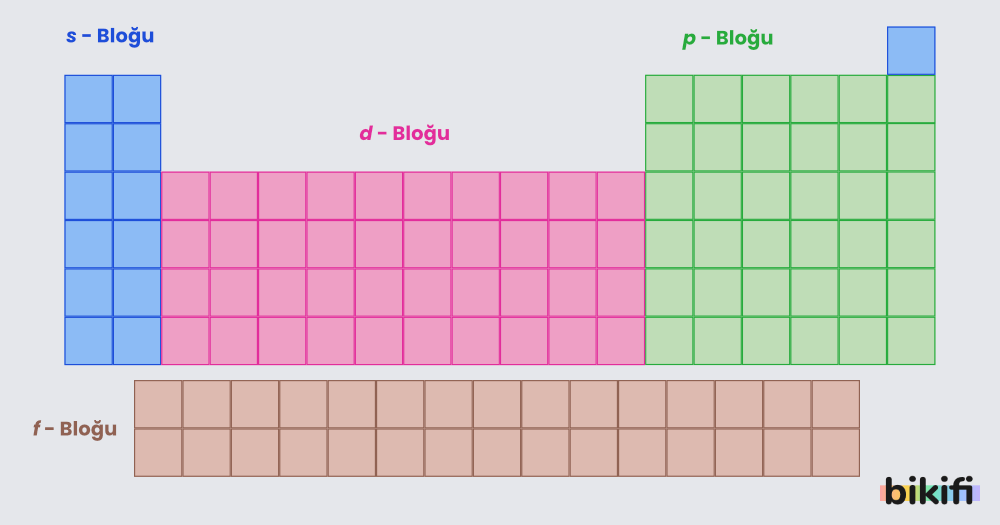
Yukarıdaki görselde de görüldüğü gibi periyodik cetvel aslında bloklardan oluşmaktadır. “S”, “P”, “D” ve “F” blokları olarak adlandırılan bu bölümler, modern atom teorisindeki “Açısal Kuantum Sayısı” nı simgelemektedir. S bloğunda bulunan bütün elementlerin son orbitali s orbitali, f bloğundaki elementlerin de son orbitali f orbitalinden oluşmaktadır. Örneğin; Hidrojen (1s1) 1 A grubunda bulunmakla birlikte S-bloğu içerisinde de bulunur. Karbon atomuna baktığımızda ise (1s2, 2s2, 2p2) hem 4A grubunda hem de P-bloğunda bulunur.
S-Bloğu Elementleri
- Helyum, 1A ve 2A grubu elementleri s-bloğunda bulunmaktadır.
- Bu blok içerisindeki her elementin elektron dağılımında son elektronları s orbitalinde bulunur.
- Her grup yine kendi grubuna ait belirleyici özellikleri taşımaktadır.
P-Bloğu Elementleri
- P bloğu 3A dan başlar ve 8A grubunu (Helyum hariç) kapsar.
- P bloğundaki her grup yine kendi özelliklerini gösterir ve elektron dizilimlerinde son elektronları p orbitali içerisinde yer alır.
- P bloğu içerisindeki herhangi bir grupta (8A hariç) yukarıdan aşağıya inildikçe metallik karakter hızla artmaktadır.
D-Bloğu Elementleri
- Elektron dağılımı d orbitali ile sonlanan elementler D bloğunda bulunmaktadır.
- 4. periyot ile birlikte periyodik cetvelde gözükürler. Bunun nedeni d orbitaliyle ilgilidir.
- D bloğu, 2A ile 3A grubu arasında yer alır.
- D bloğu, F bloğuyla birlikte periyodik cetveldeki B Grubunu oluşturmaktadır.
- D bloğundaki elementler geçiş elementleri olarak isimlendirilmektedir.
- Geçiş elementlerinin çoğu ağır metallerdir.
- Varyans elektronlarına sahip oldukları için elektriği iyi iletirler.
- Çinko (Zn), kadmiyum (Cd), civa (Hg) ve kopernikyum (Cn) elementleri tam dolu d orbitaline sahip oldukları için {(n-1)d10 -n periyot sayısı} tam olarak geçiş elementlerinin özelliklerini göstermezler.
F-Bloğu Elementleri
- F bloğu, elektron dağılımında son orbitali olarak f orbitalini bulunduran elementlerden oluşmaktadır.
- 6. periyot ile birlikte periyodik cetvelde gözlemlenirler. Bunun nedeni f orbitaliyle ilgilidir.
- 2A ile 3B grubu arasında yer alan F bloğu elementleri, periyodik cetvelde meydana gelebilecek bir karmaşıklığı önlemek için periyotların aşağısına girinti şeklinde yazılmaktadır.
- 6. periyotta bulunan f bloğu elementlerine lantanitler, 7. periyottaki f bloğu elementlerine aktinler denilmektedir.
- Lantinit sınıfında bulunan f bloğu elementi Godalinyum (Gd)’nin elektron dağılımı şu şekildedir: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f7 5d1
- Aktinleri oluşturan elementlerin çoğu doğal ortamda bulunmamaktadır ancak laboratuvar ortamında sentezlenebilmektedir.













