Etrafımızı saran hava, ocaktaki doğal gaz, parfümün kokusu… Bunların hepsi gazlarla ilgili. Gazlar, maddenin en hareketli ve en serbest halidir. Bu derste gazların temel özelliklerini, davranışlarını yöneten yasaları ve günlük hayattaki uygulamalarını öğreneceğiz. Gazların davranışlarını anlamak, hem doğayı hem de modern teknolojinin birçok alanını kavramak için gereklidir.
Gazların Özellikleri
Gazlar, maddenin üç temel halinden biridir ve kendine özgü belirgin özelliklere sahiptir. Katı ve sıvılardan farklı olarak gazlar, bulundukları kabın hem hacmini tamamen doldurur hem de şeklini alır. Bu özellik, gaz taneciklerinin birbirinden çok uzak olması ve sürekli hareket halinde bulunmasından kaynaklanır.
Gazların Genel Özellikleri
Gazların en belirgin özelliği, bulundukları kabın hacmini tamamen doldurmaları ve kabın şeklini almalarıdır. Bir parfüm şişesini açtığınızda, koku moleküllerinin tüm odaya yayılması bu özelliğin güzel bir örneğidir. Gaz tanecikleri birbirlerinden çok uzakta bulunur ve aralarında büyük boşluklar vardır. Bu nedenle gazların yoğunlukları katı ve sıvılara göre çok düşüktür.
Gazların bir diğer önemli özelliği sıkıştırılabilmeleridir. Dalış tüplerinde normal atmosfer basıncının yaklaşık 200 katı basınçta hava sıkıştırılabilir. Doğal gaz taşımacılığında da bu özellikten yararlanılır; gaz sıkıştırılarak daha küçük hacimlerde depolanır ve taşınır.
Gazların Temel Nitelikleri
Bir gazın durumunu tam olarak tanımlamak için dört temel niceliği bilmemiz gerekir: basınç, hacim, sıcaklık ve miktar.
Basınç (P)
Basınç (birim yüzeye etki eden dik kuvvet), gazların en önemli özelliklerinden biridir. Basınç şu formülle hesaplanır:
Burada P basıncı, F kuvveti, A ise yüzey alanını gösterir. Deniz seviyesinde açık hava basıncı yaklaşık 1 atmosfer (atm) değerindedir. Bu, üzerimizde kilometrelerce yükseklikte bulunan havanın ağırlığından kaynaklanır. Elimizi açık tuttuğumuzda yaklaşık 100 kg’lık bir hava kütlesi elimizin üzerine baskı yapar, ancak vücudumuzun içinden dışarıya doğru da aynı basınç uygulandığı için bunu hissetmeyiz.
Hacim (V)
Hacim (maddelerin kapladığı yer), gazın bulunduğu alanın büyüklüğünü ifade eder. Gazlar için hacim genellikle litre (L) veya metreküp (m³) cinsinden ölçülür. Normal şartlar (sıcaklığın 0°C ve basıncın 1 atm olduğu koşullar) altında 1 mol gaz yaklaşık 22,4 litre hacim kaplar. Bu değer, gazın cinsinden bağımsızdır ve tüm ideal gazlar için geçerlidir.
Sıcaklık (T)
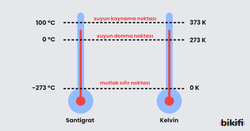
Sıcaklık (taneciklerin ortalama kinetik enerjisi), gaz taneciklerinin hareketliliğinin bir ölçüsüdür. Gazlarla ilgili hesaplamalarda mutlaka mutlak sıcaklık (Kelvin cinsinden sıcaklık) kullanılmalıdır. Celsius ile Kelvin arasındaki dönüşüm şu formülle yapılır:
Örneğin, oda sıcaklığı olan 25°C, Kelvin cinsinden 298 K’dir. Mutlak sıfır noktası (-273°C veya 0 K), teorik olarak tüm moleküler hareketin durduğu sıcaklıktır.
Miktar (n)
Gazın miktarı genellikle mol sayısı ile ifade edilir. 1 mol, 6,02 × 10²³ tane tanecik içerir. Bu sayıya Avogadro sayısı denir. Bir mol oksijen gazı da, bir mol helyum gazı da aynı sayıda molekül içerir, ancak kütleleri farklıdır.
Genleşme ve Sıkıştırılma
Gazların hacmi, sıcaklık ve basınçtaki değişimlere karşı çok duyarlıdır. Sıcaklık arttığında gaz tanecikleri daha hızlı hareket eder ve gazın hacmi genişler. Sıcak hava balonlarının yükselmesi bu prensiple çalışır: havanın ısıtılmasıyla genleşen gaz, yoğunluğu azaldığı için yukarı doğru hareket eder.
Basınç uygulandığında ise gazlar sıkıştırılabilir. Araba lastiği şişirilirken, pompayla lastiğin içine daha fazla hava molekülü sıkıştırılır. Lastiğin hacmi sabit kaldığı için içerideki basınç artar.
Yayılma
Gaz tanecikleri sürekli ve düzensiz hareket halindedir. Bu harekete Brown hareketi denir. Tanecikler her yöne doğru hareket eder, birbirleriyle ve kabın duvarlarıyla çarpışır. Bu sürekli hareket nedeniyle gazlar, bulundukları ortamda kendiliğinden yayılırlar. Bu olaya difüzyon denir.
Mutfakta pişen yemeğin kokusunun tüm eve yayılması difüzyona güzel bir örnektir. Koku molekülleri, hava molekülleriyle çarpışarak zikzak çizerek ilerler ve zamanla her yere dağılır.
Gaz Yasaları
Gazların davranışları, belirli matematiksel ilişkilerle tanımlanabilir. Bu ilişkilere gaz yasaları denir. Her yasa, gazın dört temel özelliğinden (P, V, T, n) ikisini sabit tutarak diğer ikisi arasındaki ilişkiyi inceler.
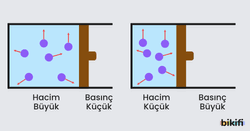
Boyle Yasası (Basınç-Hacim İlişkisi)
İrlandalı bilim insanı Robert Boyle, sabit sıcaklık ve miktarda bir gazın basıncı ile hacmi arasındaki ilişkiyi keşfetmiştir. Boyle Yasası‘na göre, sabit sıcaklıkta bir gazın basıncı ile hacmi ters orantılıdır:
Bu formül, gazın ilk durumundaki basınç (P₁) ve hacim (V₁) çarpımının, son durumundaki basınç (P₂) ve hacim (V₂) çarpımına eşit olduğunu gösterir.
Şırınga ile yapılan basit bir deneyde bu yasayı gözlemleyebilirsiniz. Şırınganın ucunu kapatıp pistonu ittiğinizde, içerideki havanın hacmi azalır ve basıncı artar. Pistonu çektiğinizde ise hacim artar, basınç azalır.
Charles Yasası (Sıcaklık-Hacim İlişkisi)
Fransız bilim insanı Jacques Charles, sabit basınçta bir gazın hacminin sıcaklıkla nasıl değiştiğini incelemiştir. Charles Yasası‘na göre, sabit basınçta bir gazın hacmi mutlak sıcaklıkla doğru orantılıdır:
Bu yasayı evde kolayca gözlemleyebilirsiniz. Şişirilmiş bir balonu buzdolabına koyarsanız büzüşür, sıcak suya tutarsanız genleşir. Bunun nedeni, sıcaklık arttıkça gaz taneciklerinin daha hızlı hareket etmesi ve daha fazla alan kaplamasıdır.
Gay Lussac Yasası (Basınç-Sıcaklık İlişkisi)
Joseph Louis Gay-Lussac, sabit hacimde tutulan bir gazın basıncının sıcaklıkla nasıl değiştiğini araştırmıştır. Gay Lussac Yasası‘na göre, sabit hacimde bir gazın basıncı mutlak sıcaklıkla doğru orantılıdır:
Kapalı bir kapta bulunan gazı ısıttığınızda basıncının arttığını gözlemlersiniz. Örneğin, deodorant kutularının üzerinde “50°C’nin üzerindeki sıcaklıklara maruz bırakmayın” uyarısı bulunur. Bunun nedeni, yüksek sıcaklıkta kutunun içindeki gaz basıncının tehlikeli seviyelere çıkabilmesidir.
Avogadro Yasası (Hacim-Miktar İlişkisi)
İtalyan bilim insanı Amedeo Avogadro, aynı sıcaklık ve basınç koşullarında eşit hacimdeki gazların eşit sayıda molekül içerdiğini keşfetmiştir. Avogadro Yasası‘na göre, sabit sıcaklık ve basınçta bir gazın hacmi mol sayısıyla doğru orantılıdır:
Bu yasa, farklı gazların aynı koşullarda aynı davranışı gösterdiğini ortaya koyar. Örneğin, aynı sıcaklık ve basınçta 1 litre hidrojen gazı ile 1 litre oksijen gazı aynı sayıda molekül içerir.
Gazların Pratik Uygulamaları
Gaz yasaları ve gazların özellikleri, günlük hayatta ve endüstride birçok alanda kullanılır. Motorlardan dalış ekipmanlarına kadar pek çok teknoloji, gazların davranışlarına dayanır.
İçten Yanmalı Motorlar
İçten yanmalı motorlar, yakıtın yanmasıyla açığa çıkan kimyasal enerjiyi mekanik enerjiye dönüştüren makinelerdir. Bu motorlarda gazların genleşme özelliğinden yararlanılır.
Pistonlu Motorlar
Otomobillerde kullanılan pistonlu motorlar, dört zamanlı bir çevrim ile çalışır:
Çalışma Döngüsü
- Emme zamanı: Piston aşağı inerken, silindir içine hava-yakıt karışımı çekilir. Charles Yasası’na göre, hacim arttığı için basınç düşer ve dışarıdan gaz içeri dolar.
- Sıkıştırma zamanı: Piston yukarı çıkarak karışımı sıkıştırır. Boyle Yasası’na göre, hacim azaldıkça basınç ve sıcaklık artar. Karışım yaklaşık 1/10 oranında sıkıştırılır.
- Yanma (güç) zamanı: Buji ateşleme yapar, karışım yanar. Gay Lussac Yasası’na göre, ani sıcaklık artışı büyük bir basınç artışına neden olur. Bu basınç pistonu aşağı iter ve güç üretilir.
- Egzoz zamanı: Yanmış gazlar dışarı atılır. Piston yukarı çıkarken egzoz gazlarını dışarı iter.
Gaz Türbinli Motorlar
Uçaklarda kullanılan jet motorları, sürekli akışlı gaz türbinleridir. Üç ana bölümden oluşur:
- Kompresör: Havayı sıkıştırarak basıncını ve sıcaklığını artırır. Boyle ve Gay Lussac yasaları burada devreye girer.
- Yanma odası: Sıkıştırılmış havaya yakıt püskürtülür ve yakılır. Sıcaklık 2000°C’ye kadar çıkabilir.
- Türbin: Yüksek basınç ve sıcaklıktaki gazlar türbin kanatlarını döndürür ve arkadan büyük hızla çıkar.
İtiş Gücü Oluşumu
Newton’un etki-tepki yasasına göre, gazların arkaya doğru yüksek hızda atılması, uçağı ileri doğru iter. Gazların genleşmesi ve hızlanması, Charles ve Gay Lussac yasalarıyla açıklanır.
Dalış Ekipmanları
Dalış, gazların basınç altındaki davranışlarının hayati önem taşıdığı bir aktivitedir.
Dalış tüplerinde normal havanın bileşimine yakın bir karışım bulunur: %78 azot, %21 oksijen. Bu gaz karışımı yaklaşık 200 atmosfer basınç altında sıkıştırılmıştır. Boyle Yasası’na göre, 200 atm basınçta gazın hacmi normale göre 200 kat azalmıştır.
Denizin derinliklerine indikçe, her 10 metrede yaklaşık 1 atmosfer basınç artar. 30 metre derinlikte toplam basınç 4 atmosferdir (1 atm hava + 3 atm su). Henry Yasası’na göre, artan basınçla birlikte kanda çözünen gaz miktarı da artar.
Vurgun (dekompresyon hastalığı), dalgıcın hızlı yükseldiğinde kanda çözünmüş azot gazının kabarcıklar oluşturması sonucu oluşur. Bu kabarcıklar damarları tıkayarak ciddi sağlık sorunlarına neden olabilir. Bu nedenle dalgıçlar yavaş yavaş yüzeye çıkar ve belirli derinliklerde dekompresyon durakları yapar.
📚 Konuyla İlgili Terimler Özeti
- Basınç (⭐⭐⭐): Birim yüzeye etki eden dik kuvvet. P = F/A formülüyle hesaplanır. Günlük hayatta lastik şişirme, tansiyon ölçümü gibi durumlarda karşımıza çıkar. Deniz seviyesinde açık hava basıncı 1 atmosferdir.
- Mutlak sıcaklık (⭐⭐⭐): Kelvin cinsinden ifade edilen sıcaklık değeri. T(K) = t(°C) + 273 formülüyle hesaplanır. Gaz hesaplamalarında mutlaka Kelvin kullanılmalıdır çünkü Kelvin skalası mutlak sıfır noktasından başlar.
- Mol sayısı (⭐⭐⭐): Madde miktarının bir ölçüsü. 1 mol = 6,02 × 10²³ tanecik = Avogadro sayısı. Kimyasal reaksiyonlarda ve gaz hesaplamalarında temel birimdir.
- Kinetik moleküler teori (⭐⭐⭐): Gazların tanecik düzeyindeki davranışlarını açıklayan teori. Gazların neden genleştiğini, sıkıştırılabildiğini ve yayıldığını moleküler düzeyde açıklar.
- Normal şartlar (NŞA) (⭐⭐): 0°C sıcaklık ve 1 atm basınç koşulları. Bu koşullarda 1 mol ideal gaz 22,4 litre hacim kaplar.
- Brown hareketi (⭐⭐): Gaz taneciklerinin sürekli, düzensiz, zikzaklı hareketi. Polen taneciklerinin su içindeki hareketinde gözlemlenir.
- Esnek çarpışma (⭐⭐): Toplam kinetik enerjinin korunduğu çarpışma türü. Gaz tanecikleri arasındaki çarpışmalar esnek kabul edilir.
- Açık hava basıncı (⭐): Atmosferdeki gazların yeryüzüne uyguladığı basınç. Rakım arttıkça azalır.
- Vurgun (⭐): Dalgıçlarda hızlı yükselme sonucu kanda azot gazı kabarcıklarının oluşması ve damarları tıkaması durumu.