Atom kavramı, tarih boyunca filozofların ve bilim insanlarının en önemli araştırma konularından biri olmuştur. Bilimsel temellerden yoksun bir şekilde, ilk olarak Antik Yunan döneminde Demokritos gibi düşünürler maddenin son derece küçük, bölünemeyen taneciklerden (atomlardan) oluştuğunu öne sürmüştür. Ancak gerçek anlamda “bilimsel temelli” atom teorileri, 19. yüzyılın başlarından itibaren deney ve gözlemlere dayandırılarak geliştirilmiştir.
Hipotez Teori ve Modeller
- Hipotez: Belirli bir problemi veya olayı açıklamak için öne sürülen, henüz yeterince test edilmemiş bilimsel öneridir. Bilim insanları hipotezlerini deneylerle, gözlemlerle ve istatistiksel analizlerle sınarlar.
- Teori: Bir hipotez çeşitli deney, gözlem ve araştırmalarla defalarca doğrulanıp desteklenirse daha geniş kapsamlı bir açıklama haline gelir. Teoriler, mevcut verilerle en uyumlu modeller sunar ve yeni öngörülerde bulunabilirler.
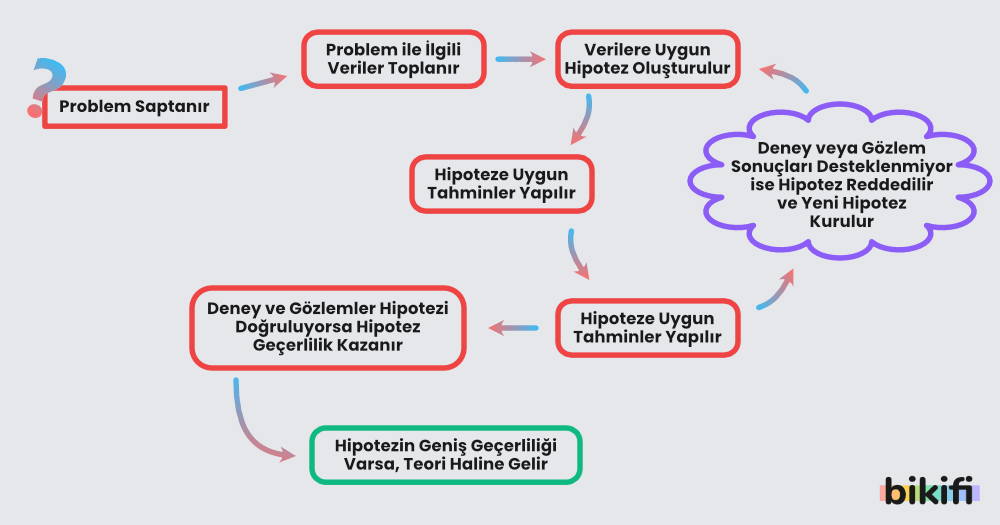
Model, bir gerçekliği veya kuramsal bir açıklamayı temsil etmeye yarayan, semboller, görseller, matematiksel ifadeler ya da çeşitli araçlarla oluşturulmuş bir yapıdır. Bilimsel çalışmalarda modeller; karmaşık sistemleri, olayları veya süreçleri sadeleştirerek anlaşılabilir hâle getirir, böylece teori ve olgular arasındaki ilişkiyi görselleştirmeyi ve test etmeyi kolaylaştırır.
Tarihsel Atom Modelleri ve Gelişim Süreci
Dalton Atom Teorisi (1803)
- Madde: Her elementin yapı taşı, bölünemeyen ve birbirinin tıpatıp aynı olan atomlardır.
- Farklı Elementler: Her elementin atomları özgündür ve başka bir elementin atomlarından farklı özellikler taşırlar.
- Bileşik Oluşumu: Farklı element atomları sabit oranlarda birleşerek bileşikleri meydana getirir.
- Kimyasal Tepkimeler: Atomlar parçalanmaz, yok olmaz veya başka bir elementin atomuna dönüşmez. Sadece yeniden dizilir veya birleşir.
Dalton’un teorisi, kütlenin korunumu ve sabit oranlar yasasını atom temelli olarak açıklamaya katkı sağladı. Ancak dalton, atom modelinde; atomun boşluklu yapısı, izotop atom kavramı ve atom yapısındaki elektriksel yapı açıklanamamıştır.
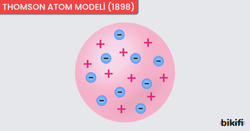
Thomson Atom Modeli (1897)
- Elektronun Keşfi: J. J. Thomson, katot ışınları deneyleriyle negatif yüklü elektronun varlığını kanıtladı.
- Üzümlü Kek Modeli: Atomun pozitif yüklü bir bulut içerisinde, elektronların serpiştirilmiş gibi dağıldığı düşünmüştür.
- Sabit Kütle Dağılımı: Atom kütlesinin çoğunlukla pozitif bulutta homojen olarak yayıldığı varsaymıştır. Başka bir deyişle, elektronlar çok küçük ve hafiftir, atoma ağırlığını veren protonlardır.
Thomson modeli, atomda negatif yüklü elektronların varlığını ilk kez göstermesi açısından büyük bir adım olmuştur. Ancak pozitif yükün tam olarak nasıl konumlandığı ve çekirdeğin yapısı henüz net değildi.
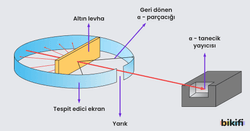
Rutherford Atom Modeli (1911)
- Altın Levha Deneyi: Rutherford ve ekibi, alfa taneciklerini (pozitif yüklü) çok ince altın yaprağa doğru gönderdi. Beklenti, Thomson modeline göre taneciklerin büyük oranda sapmadan geçmesiydi.
- Deney Sonucu: Alfa taneciklerinin çoğu sapmadan geçerken, çok az bir kısmı büyük açılarla saçıldı. Bu, atomda küçük fakat yoğun ve pozitif yüklü bir çekirdek olduğunu gösterdi.
- Boşluk Kavramı: Atomun büyük kısmı boşluktan oluşur, elektronlar çekirdek çevresinde bu boşlukta bulunur.
Rutherford modeli, çekirdek kavramını ve atomun çoğunlukla boş alan olduğunu açıklamasıyla büyük önem taşır. Rutherford Atom Modelinin eksiklikleri:
- Rutherford modeli atomdaki elektronların hareketlerini açıklayamadığı gibi elektronların niçin çekirdek üzerine düşmedikleri sorusunu da yanıtlayamamaktadır.
- Daha sonraki yıllarda Chadwick, atom çekirdeğinde nötron denilen yüksüz bir taneciğin varlığını saptamıştır. Bu şekilde, atomun üç temel tanecikten oluştuğu anlaşılmıştır.
Bohr Atom Modeli (1913)

- Kuantize Yörüngeler: Elektronların çekirdekten belirli uzaklıklarda (enerji seviyelerinde) dairesel yörüngelerde dönebileceğini öne sürer.
- Enerji Soğurma ve Yayma: Elektron, düşük enerjili yörüngeden yüksek enerjili yörüngeye geçmek için “soğurma (absorpsiyon)” yapar. Tersine, yüksek enerjili yörüngeden düşük enerjiye inerken “yayma (emisiyon)” şeklinde foton salar.
- Hidrojen Spektrumu: Bohr’un formülleri özellikle hidrojen atomunun çizgi spektrumunu açıklamada başarılı olmuştur. Örneğin hidrojenin enerji seviyeleri için ifadesi sıkça kullanılır.
- Kararlılık Sorunu: Elektronlar izin verilen yörüngelerde kararlı bir şekilde hareket edebilir; Rutherford modelindeki “elektronun çekirdeğe düşme” problemi bu şekilde açıklanmaya çalışılmıştır.
Bohr modeli, tek elektronlu sistemler (örn. hidrojen) ve hidrojen benzeri iyonlar (He+, Li2+ vb.) için başarılı olsa da çok elektronlu atomlarda yetersiz kalır. Bu eksikliği gidermek için daha gelişmiş kuantum teorisi ortaya atılmıştır.
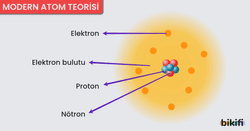
Modern Atom Teorisi (Kuantum Modeli)
Modern atom teorisi, Bohr modelinde açıklanamayan pek çok detayı kuantum mekaniği prensipleriyle bütünleştirerek çözümler. Özellikle Heisenberg’in Belirsizlik İlkesi ve Schrödinger’in Dalga Denklemi, elektronun davranışını daha gerçekçi biçimde açıklar.
Modern atom teorisi kabul görmeden önce şu gelişmeler gerçekleşmiştir;
- 1924 yılında W. Pauli elektronların değişik enerji seviyelerine (katman) dağılışları ve enerji seviyeleri arasındaki elektron geçişleri hakkında Pauli ilkesini ortaya koydu.
- 1932 yılında James Chadwick, çekirdek içindeki nötronları buldu.
- Heisenberg belirsizlik ilkesi kabul gördü. Bu ilkeye göre atomdaki elektronun yeri ve hızı, aynı anda, tam bir kesinlikle belirlenemez.
- E. Schrödinger kendi adıyla anılan denkleminde elektronların bulunma ihtimalinin yüksek olduğu uzay bölgelerini tespit etti.
Modern atom teorisi ile ilgili temel noktalar şöyle özetlenebilir:
- Dalga-Parçacık İkiliği: Elektron, hem dalga hem de parçacık özelliği sergiler.
- Heisenberg Belirsizlik İlkesi: Elektronun konumu ve hızı (momentumu) aynı anda kesin olarak bilinemeyebilir. Bu belirsizlik, klasik yörünge kavramını geçersiz kılar.
- Olasılık Bulutu (Orbital): Elektronlar belirli bir “yörünge”de değil, çekirdek çevresinde bulunma ihtimallerinin yüksek olduğu orbital adlı hacimsel bölgelerde bulunurlar.
Kuantum modeli sayesinde, çok elektronlu atomların elektronik yapılarını (örneğin periyodik sistemdeki elementlerin elektron dizilimlerini) daha anlaşılır kılmak ve kimyasal özellikleri açıklamak mümkün olmuştur. Modern atom teorisine göre Bohr atom teorisindeki gibi elektronları yörüngelerde sabit hızla dönen tanecikler olarak düşünmek yanlıştır.
Atomun Temel Tanecikleri
Günümüzde atomun, proton, nötron ve elektron olmak üzere üç temel parçacıktan oluştuğu kabul edilir (daha fazla “atom altı” parçacık bulunsa da temel kimya düzeyinde bu üçü önemlidir):
| Tanecik | Kütle (g) | Bağıl Kütle | Elektrik Yükü (C) | Bağıl Yük |
|---|---|---|---|---|
| Elektron (e–) | 0.0005486 | -1 | ||
| Proton (p+) | 1.007276 | +1 | ||
| Nötron (n0) | 1.008665 | 0 | 0 |
Bir atom genel olarak nötr kabul edilir; dolayısıyla proton sayısı = elektron sayısı. Proton sayısı (p+) aynı zamanda atom numarası (Z) olarak adlandırılır ve her elementi tanımlar. Nötron sayısı (n0) ise izotop kavramıyla ilişkilidir. Kütle numarası (A) ise “proton + nötron” toplamıdır: .
Bohr Atom Teorisi
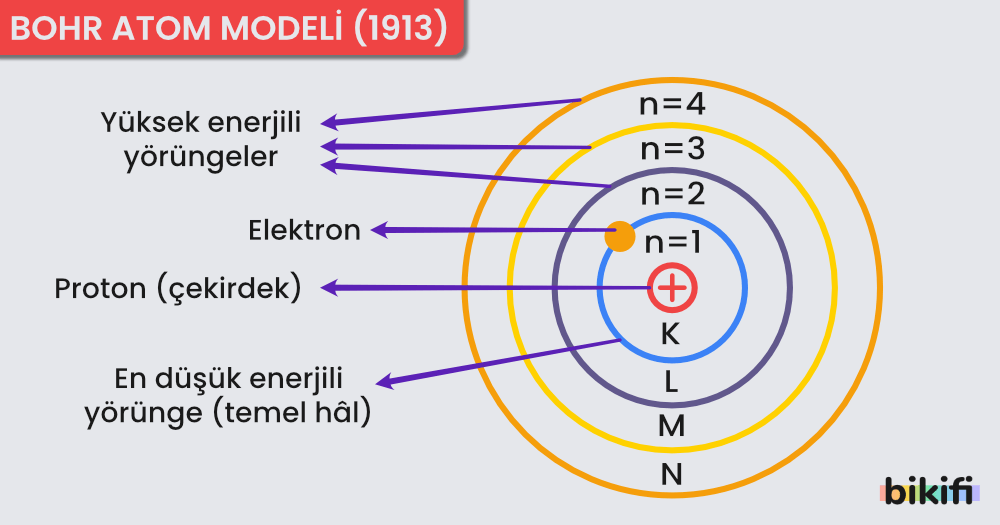
Bohr Atom Modelinin Temel İlkeleri
Bohr’a göre atomdaki elektronlar, çekirdeğin çevresinde belirli yarıçapa sahip dairesel yörüngelerde (enerji seviyelerinde) hareket eder. Bu yörüngeler:
- Çekirdekten uzaklaştıkça enerji artar.
- n = 1, 2, 3, 4 … gibi tam sayılarla ifade edilir. Her n değeri, farklı bir enerji seviyesine denk gelir.
Elektronun n. enerji seviyesindeki enerjisi, hidrojen atomu için basitçe aşağıdaki gibi verilir:
Burada:
- ( m ) elektronun kütlesi,
- ( e ) elektronun yükü,
- ( \epsilon_0 ) ise boşluğun dielektrik sabitidir.
- Temel h�âl: Elektronun bulunabileceği en düşük enerji seviyesidir (n=1).
- Uyarılmış hâl: Elektronun, temel hâle göre daha yüksek bir enerji seviyesinde (n > 1) bulunmasıdır.
Enerji Soğurma ve Yayma (Absorpsiyon ve Emisyon)
Elektron, bulunduğu yörüngeden daha yüksek enerjili bir yörüngeye geçerken, dışarıdan enerji alır (soğurma, absorpsiyon). Tam tersi biçimde, daha yüksek enerjili bir yörüngeden daha düşük enerjili bir yörüngeye inerken enerji verir (yayma, emisyon).
- Soğurma (absorpsiyon): Atom enerji absorblayarak elektronu yüksek seviyeye taşır.
- Yayma (emisyon): Uyarılmış atom, kararsız durumdayken elektron düşük seviyeye geçer ve foton formunda enerji yayar.
Bu süreçler, elektronun yörüngeler arası enerji farkı kadar enerji alıp vermesiyle gerçekleşir. Örneğin:
Burada ( h ) Planck sabiti, ( \nu ) ise yayımlanan veya soğrulan ışığın frekansıdır.
Bohr Atom Modelinin Yetersiz Kaldığı Alanlar
Bohr modeli, hidrojen benzeri (tek elektronlu) sistemlerin spektrumlarını başarılı bir şekilde açıklasa da:
- Birden fazla elektrona sahip atomlarda yetersiz kalır.
- Elektronların yalnızca dairesel yörüngelerde bulunabileceğini varsayar.
- Heisenberg Belirsizlik İlkesi’ne göre elektronun konumu ve hızı aynı anda kesin olarak belirlenemez.
Bu nedenlerle, elektronların atom içindeki konumu olasılık dağılımı ile açıklanmaya başlanmış ve modern atom teorisi doğmuştur.
Modern Atom Teorisi ve Orbital Kavramı
Modern atom teorisi, Bohr’un sabit yörüngeler fikri yerine olasılık temelli bir yaklaşım getirir. Bu modele göre elektronun atom içindeki tam konumu kesin olarak belirlenemez; ancak elektronun bulunma ihtimalinin yüksek olduğu uzay bölgeleri tanımlanabilir. Bu olasılık dağılımını, Heisenberg Belirsizlik İlkesi destekler.
Orbital Tanımı
- Orbital, elektronun atom içerisinde bulunma ihtimalinin yüksek olduğu üç boyutlu bir bölge olarak tanımlanır.
- Bohr modelinde olduğu gibi tek bir dairesel yörünge kavramı yoktur. Elektron, dalga fonksiyonuyla ifade edilir ve elektronun konumuyla ilgili bilgi, olasılık dağılımı üzerinden elde edilir.
- Orbital bölgelerini ifade etmek için bazı kavramlar kullanılır:
- Baş Kuantum Sayısı (): Elektronun temel enerji seviyesini gösterir (1, 2, 3, …).
- Açısal Momentum Kuantum Sayısı (): 0’dan (n-1)’e kadar değer alır ve orbitalin alt türünü (s, p, d, f) belirler.
- Manyetik Kuantum Sayısı (): -l’den +l’ye kadar değer alır; orbitalin uzaydaki yönelimini belirtir.
- Spin Kuantum Sayısı (): Elektronun spinini (+1/2 veya -1/2) temsil eder.
Modern Atom Teorisi Enerji Seviyeleri
Modern atom teorisinin modelinin varsayımları şunlardır:
- Elektronlar çekirdek çevresinde belirli enerji düzeylerinde bulunur. Her enerji düzeyi “n” ile belirtilir. Bu enerji düzeylerine baş kuantum sayısı denir. Baş kuantum sayısı orbitallerin çekirdekten ortalama uzaklığını ya da enerjisini belirler. Çekirdekten uzaklaştıkça enerji artar. Çünkü protonların elektronları çekim gücü azalır, buna bağlı olarak da elektronların hareketi ve enerjisi artar.
- Elektronlar hem kendi çevrelerinde hem de çekirdek çevresinde döner. Elektronun kendi ekseni etrafında dönme hareketine spin hareketi, çekirdek çevresindeki dönme hareketine de yörüngesel hareketi denir. Çekirdek çevresinde dönmeleri sırasında elektronların bulunma ihtimalinin yüksek olduğu geometrik bölgelere orbital denir.
- Herhangi bir temel enerji seviyesinde n² kadar orbital bulunur.
- Her temel enerji seviyesinde orbital sayısının 2 katı kadar elektron bulunabilir. Buna göre bir temel enerji seviyesindeki en fazla elektron sayısı 2n²
- Ana enerji seviyesi (baş kuantum sayısı ) yanında açısal momentum kuantum sayısı (), manyetik kuantum sayısı () ve spin kuantum sayısı () gibi ek kavramlar tanımlanır. Böylece s, p, d, f gibi farklı orbitaller ve bunların uzaydaki yönelimleri açıklanır.
Farklı Orbital Tipleri
Modern atom teorisine göre atomda birden fazla tipte ve farklı enerjilerde orbital mevcuttur. Başlıca s, p, d, f gibi alt katmanlarla ifade edilirler:
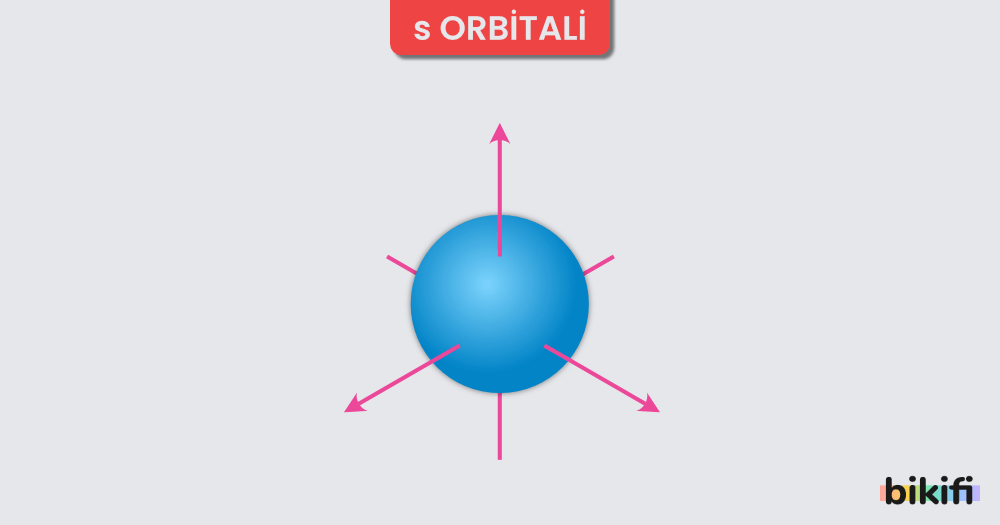
- s Orbitali:
- Şekil olarak küreseldir.
- 1s, 2s, 3s gibi enerji seviyeleri büyüdükçe yarıçapları da artar.
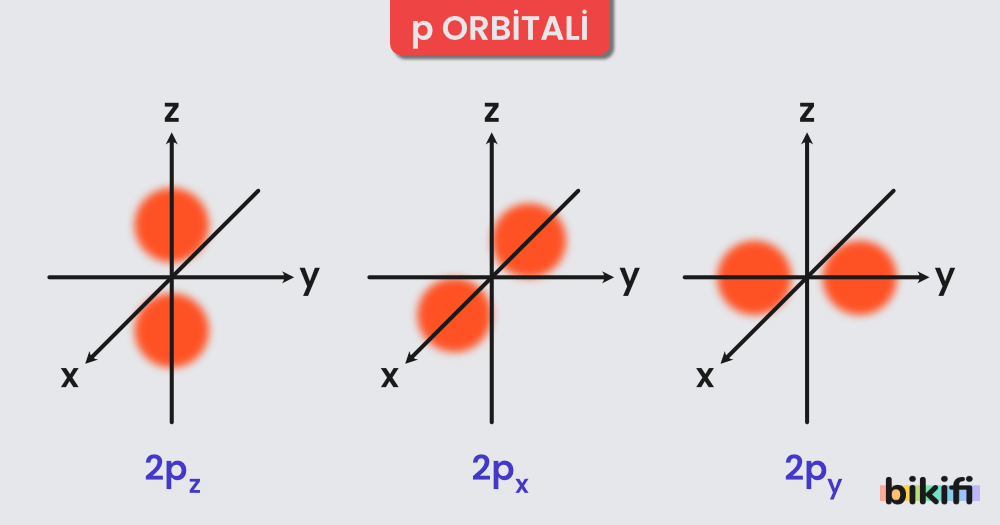
- p Orbitali:
- Şekil olarak çift loblu ya da dumbbell biçimindedir.
- 2p, 3p gibi enerji seviyelerine ayrılır ve x, y, z eksenlerine göre (px, py, pz) farklı uzaysal yönelimleri vardır.
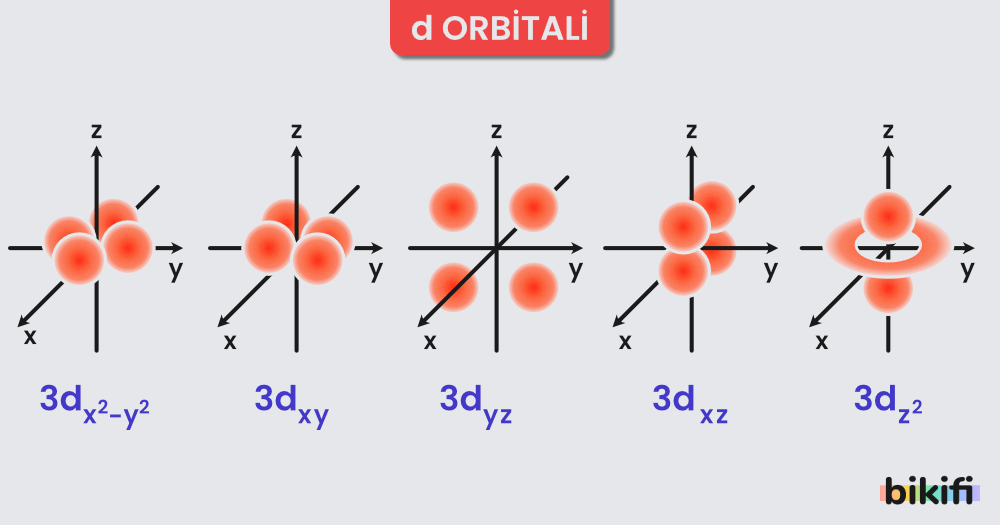
- d ve f Orbitalleri:
- Daha karmaşık şekillere sahiptirler.
- Yüksek enerji seviyelerinde bulunurlar ve çok elektronlu atomlarda belirgin hâle gelirler.
Kuantum Mekaniğinin Rolü
Kuantum mekaniği, elektronların sadece parçacık gibi değil, aynı zamanda dalga özelliği gösterdiğini belirtir. Bu yaklaşım sayesinde:
- Elektronun hız ve konumu aynı anda tam doğrulukla bilinemez (Heisenberg Belirsizlik İlkesi).
- Her orbitalin enerjisi ve şekli, kuantum sayıları (n, l, m, ms) kullanılarak tanımlanır.
Bilimsel bilginin doğası gereği, “kesin” olarak kabul edilen fikirler zaman içinde gözden geçirilebilir ya da daha kapsayıcı kuramlarla genişletilebilir. Atom konusu da bunun en iyi örneklerinden biridir. Araştırmalar devam etmekte, parçacık fiziği ve kuantum mekaniği alanlarında gelişmeler oldukça atom hakkında daha derin anlayışlar ortaya çıkmaktadır.