Atomlar, yapılarında bulunan elektronların nasıl düzenlendiğini anlamak için “orbital” kavramına ihtiyaç duyarız. Elektronların hangi enerji seviyelerinde ve hangi alt katmanlarda yer aldığını bilmek, kimyasal tepkimeleri ve elementlerin özelliklerini kavramamızı kolaylaştırır.
Orbital Kavramı
Atom modelinde elektronlar belirli katmanlara (enerji seviyelerine) ve bu katmanların içindeki alt katmanlara (orbitallere) yerleşirler. “Orbital”, elektronun bulunma olasılığının yüksek olduğu üç boyutlu bir bölgedir.
- Klasik “yörünge” (gezegen yörüngesi gibi) anlayışından farklı olarak, orbital bir hacimsel olasılık alanıdır.
- Elektronun konumunu tam olarak belirleyemeyiz; yalnızca bulunma ihtimalinin yüksek olduğu bölgeleri tanımlayabiliriz.
Bir orbital, elektronun çekirdek çevresinde bulunma olasılığının yüksek olduğu uzay bölgesidir. Her orbitalin boyutu, şekli ve enerjisi, elektronun kuantum sayılarıyla tanımlanır. Başlıca kuantum sayıları şunlardır:
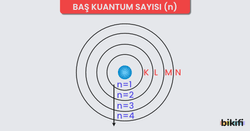
- Baş kuantum sayısı (n): Orbitalin genel boyutunu ve ana enerji seviyesini belirler (örneğin 1, 2, 3…).
- Açısal momentum kuantum sayısı (l): Orbitalin şeklini belirler (örneğin s, p, d, f).
- Manyetik kuantum sayısı (ml): Orbitalin uzaydaki yönelimini (yönünü) belirler.
- Spin kuantum sayısı (ms): Elektronun kendi ekseni etrafındaki dönüşü ile ilişkilidir ( +1/2 veya -1/2 ).
Günlük hayattan bir örnek vermek istersek: Farklı katlarda yer alan odalar (enerji seviyeleri), her odanın şekli (orbital tipi) ve odanın baktığı yön (orbitalin uzayda yönelimi) gibi düşünebilirsiniz.
Orbitallerin Şekilleri ve Özellikleri
Her alt enerji seviyesi (s, p, d, f) farklı orbital şekillerine sahiptir:
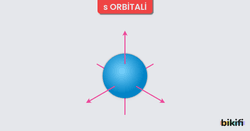
- s Orbitalleri
- Küresel bir şekle sahiptir.
- Baş kuantum sayısı (n) arttıkça s orbitalinin yarıçapı da artar.
- Örneğin 1s, 2s, 3s gibi orbitallerin büyüklükleri farklıdır ancak temel şekil küreseldir.
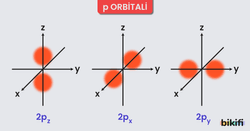
- p Orbitalleri
- Üç farklı yönelimi vardır (x, y ve z eksenlerine göre).
- “Dumbbell” (halter) şeklinde veya “sonsuzluk işareti”ne benzetilir.
- Her bir p orbitalinin enerjisi aynıdır, ancak uzayda farklı yönlere bakar.
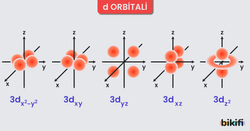
- d Orbitalleri
- Daha karmaşık şekilleri vardır (örneğin çift “dumbbell” veya halkalı yapılar).
- Beş farklı yönelime sahiptir.
- Özellikle 3d orbitalleri, 4s ve 4p orbitallerinin enerji sıralamasıyla yakından ilgilidir.
- f Orbitalleri
- Şekilleri daha da karmaşıktır.
- Yedi farklı yönelime sahiptir.
- Lise düzeyinde genellikle temel tanımlama yapılır; ayrıntılı inceleme ileri düzeyde gerçekleşir.
Her alt katman, farklı sayıda elektronu barındırabilir. Örneğin:
- s orbitalinde en fazla elektron bulunabilir.
- p alt katmanında (p orbitalleri) toplam elektron bulunabilir.
- d alt katmanında (d orbitalleri) toplam elektron bulunabilir.
- f alt katmanında (f orbitalleri) toplam elektron bulunabilir.
Orbitallerin şekil ve yönelim farklılıkları, kimyasal bağların oluşumunda ve molekül geometrilerinin belirlenmesinde büyük önem taşır.
Atom Orbitallerinin Bağıl Enerjileri
Birden çok elektrona sahip atomlarda, orbitallerin enerjileri yalnızca baş kuantum sayısına (n) değil, aynı zamanda açısal momentum kuantum sayısına (l) da bağlıdır. Bu yüzden 4s orbitalinin enerjisi 3d’den daha düşük olabilir.
- Genellikle aynı n değerine sahip orbitallerin enerjileri birbirine yakındır.
- Fakat artan çekirdek yükü ve elektronlar arası itme gibi nedenlerle, bazı orbitallerin enerjisi öngördüğümüzden farklı sıralanabilir (örneğin, 4s orbitallerinin enerjisi 3d’den önce dolabilir).
- Enerji seviyelerinin sıralanması genel olarak şu şekildedir: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < …
- Bu sıralama, çok elektronlu atomlar için geçerli “yaklaşık” bir sıradır ve elektronlar bu sıraya göre yerleşir.

Not: Hidrojen gibi tek elektronlu sistemlerde (H, He+, Li2+ vb.), alt katmanlar (s, p, d, f) aynı ana seviyede (örneğin n=2) eş enerjilidir. Ancak çok elektronlu sistemlerde, elektronlar arasındaki etkileşimler bu enerjileri farklılaştırır.
Elektron Dizilimi
Elektron dizilimi, bir atomdaki elektronların hangi orbital veya alt katmana (subshell) nasıl yerleştiğini gösterir. Elektronlar, orbitallere belirli kurallara göre yerleşir. Bu kurallar şunlardır:
- Aufbau İlkesi:
- Elektronlar, en düşük enerjili orbitalden başlayarak daha yüksek enerjili orbitallere doğru sırasıyla yerleşir.
- Dolayısıyla önce 1s, sonra 2s, sonra 2p gibi bir sıralama izlenir.
- Pauli Dışarlama İlkesi:
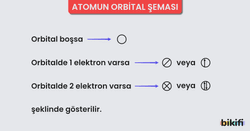
- Bir orbitalde, zıt spinli olmak koşuluyla en fazla 2 elektron bulunabilir. Yani aynı orbital içinde iki elektronun tüm kuantum sayıları aynı olamaz. Örneğin:
- “s” orbitaline 2 elektrondan fazlası sığmaz.
- “p” orbitalinin her bir yönelimi (px, py, pz) en fazla 2 elektron alır.
- Bir orbitalde, zıt spinli olmak koşuluyla en fazla 2 elektron bulunabilir. Yani aynı orbital içinde iki elektronun tüm kuantum sayıları aynı olamaz. Örneğin:
- Hund Kuralı:
- Aynı enerjili orbitaller (örneğin üç p orbitalinin her biri) önce tek elektron alır, sonra ikinci elektronlar eşleşmeye başlar.
- Bu kural, elektronlar arasındaki itmenin en aza indirilmesi amacıyla geliştirilmiştir.
Örneğin, karbon (Z=6) atomunun elektron dizilimini düşünürken şu sıralamayı izleriz:
- 1s orbitaline 2 elektron
- 2s orbitaline 2 elektron
- 2p orbitaline 2 elektron (p orbitalleri sırasıyla tek tek dolar)
Dolayısıyla karbonun elektron dizilimi kısaca şeklinde yazılabilir.

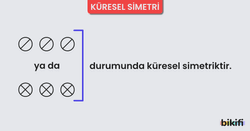
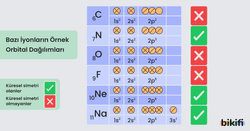
Küresel Simetri
Eş enerjili orbitallerin yarı dolu veya tam dolu olması atoma küresel simetri özelliği kazandırır. Eş enerjili orbitallerin yarı dolu veya tam dolu olması durumunda elektronlar çekirdek tarafından daha kuvvetli çekildiğinden çekirdeğe yaklaşır ve atom çapı küçülür. Bu durum atoma kararlılık kazandırır. Örneğin; s orbitalinde 1 veya 2, p orbitalinde 3 veya 6, d orbitalinde 5 veya 10, f orbitalinde 7 veya 14 elektron bulunması atoma küresel simetrik yapı kazandırır.
Elektron Dizilimini Günlük Hayattan Benzetme
Elektronların yerleşimini bir apartman dairesi örneği ile açıklayabiliriz:
- Enerji seviyeleri: Apartmanın katları (1. kat, 2. kat, 3. kat…).
- Alt katmanlar (orbitaller): Aynı katta bulunan farklı daireler (s, p, d, f).
- Pauli İlkesi: Her dairede (orbitale) en fazla 2 kişinin (elektronun) kalabilmesi.
- Hund Kuralı: Aynı katta boş daireler varken, insanlar (elektronlar) tek bir dairede toplanmak yerine önce farklı dairelere yerleşmeyi tercih ederler.
Elektron Dizilimi ve Günlük Hayattaki Uygulamaları
Günlük hayatta pek çok alanda kullandığımız malzemelerin renkleri, özellikleri ve tepkimeleri atomların elektron dizilimiyle yakından ilişkilidir. Özellikle metal iyonları içeren bileşiklerin renkli olması, orbitaller arasındaki elektron geçişleriyle açıklanır.
- Renk Oluşumu: Geçiş metalleri gibi d orbitalleri kısmen dolu olan elementler, görünür ışıkla etkileşime girerek elektronlarını farklı enerji seviyelerine geçirebilirler. Bu geçişler, belirli dalga boylarındaki ışığın soğurulmasına ve dolayısıyla maddenin geri yansıttığı rengin farklı görünmesine neden olur.
- Malzeme Teknolojisi: Elektron geçişlerine bağlı renk değişimleri, boyalar ve pigmentler gibi malzemelerin tasarımında ve üretiminde önemli bir yere sahiptir. Örneğin, vitray camlarda kullanılan metal oksitler farklı renkler oluşturur.
- Kimyasal Bağlar ve Dayanıklılık: Orbitallerin doluluk durumu, elementlerin kimyasal bağ yapabilme kapasitelerini ve dayanıklılık özelliklerini de etkiler. Bazı metallerin alaşım halindeyken kazandığı sertlik veya esneklik, elektron dizilimindeki etkileşimlerden kaynaklanır.
- Biyokimya ve Diğer Disiplinler: Hemoglobin gibi biyolojik moleküllerde bulunan metal merkezleri (örneğin demir) de elektron diziliminden etkilenerek oksijen taşıma gibi hayati fonksiyonları yerine getirir. Bu nedenle atom orbitalleri ve elektron dağılımı, kimya dışında biyoloji ve tıp gibi alanlarda da önem taşır.