Periyodik cetvel, kimyasal elementlerin sınıflandırılması için geliştirilmiş tablodur. Günümüzde periyodik tablo, periyodik çizelge, elementler tablosu gibi bir çok isimle ifade edilmektedir. Doğada bulunan elementlerin daha kolay incelenebilmesi, arandığında daha kolay bulunabilmesi için tasarlanmıştır. Güncel olarak kullanılan periyodik cetvel elementlerin artan atom numaralarına göre sıralanarak oluşturulmuştur. 1869 yılında Dimitri Mendeleev tarafından temelleri atılmıştır.
Tarihçe
Tarih boyunca insanlar buldukları elementleri sınıflandıran bir sisteme ihtiyaç duymuşlardır. 1860’lı yıllarda bilim insanları tarafından 60 element bilinmektedir ve bazı elementlerin benzer özellikler gösterdiği keşfedilmiştir. Genellikle tasarlanan öncül periyodik cetvellerde bu özellikler üzerine durulmuştur.
Triadlar (Döbereiner)
Döbereiner, elementlerin sınıflandırılması ile ilgili ilk çalışmayı yapmıştır. Atomik kütlelerine bağlı olarak benzer özellik gösteren elementlerden üçerli gruplar oluşturmuştur. Döbereiner’a göre triadlar sisteminde bulunan bir üçlü grup içerisindeki 1. ve 3. elementin atom kütlesinin ortalaması 2. elementin atom kütlesini verir. Örneğin “Klor (k: 35.5), Brom (k: 79,9), İyot (k: 127)” üçlüsünde, (klor + iyot)/2=brom denklemi yaklaşık olarak sağlanır. Döbereiner bu sistem aracılığıyla “elementlerin fiziksel özelliklerinin atom kütleleri ile değiştiği” fikrini ortaya atmıştır.
Oktavlar (John Alexander Newlands)
John Alexander Newlands her 8 elementte bir bazı özelliklerin tekrar ettiğini fark etti, bunun üzerine bilinen elementlerin artan atom kütlelerine göre sıralayarak bir tablo yaptı. Sıralama sırasında benzer özellik gösteren elementleri aynı sırada göstermeye çalışmıştır. Newlands’ın bulduğu bu kurala oktavlar yasası denir. O dönemde oktavlar kuralı sayesinde bilinmeyen bazı elementler hakkında doğru tahminler yapabilmesine rağmen kalsiyumdan sonraki elementler bu kurala uymadığı için diğer bilim adamları tarafından kabul görmemiştir.
Mendeleev
Alman kimyacı Lothar Meyer ve Rus kimyacı Dimitri Mendeleev, birbirilerinden bağımsız olarak Newlands’ın kuramlarını incelemiş ve kapsamlı olarak geliştirilmiş yeni bir tablo geliştirdiler. Meyer’in tablosu kimyasal özellik yerine fiziksel özellikleri baz aldığı için kimyacılar tarafından tercih edilmedi.
Mendeleev ise dönemin bilinen elementlerinin bağıl atom kütlesinin, bazı fiziksel ve kimyasal özelliklerinin ve elementin sembolünün bulunduğu kartları artan atom kütlelerine göre yatay olarak sıralamıştır. Benzer özelliklerin bulunmasına göre alt sütuna geçişler yapmıştır. Mendeleev yapmış olduğu çalışmalar sayesinde bazı keşfedilmemiş elementlerin özelliklerini doğru tahmin etmiştir ancak bazı elementlerin yeri bulunması gereken yerden farklı olmuştur.
Moseley
Mendeleev’in çalışmalarından sonra Rutherford 1911 yılında atom çekirdekleri alfa parçacıklarının saçılması deneyiyle çekirdek yükünün belirlenebileceğini gösterdi. Bu keşiften 2 yıl sonra Moseley x-ışınlarıyla yaptığı çalışmalar sayesinde Mendeleev’in tablosundaki hatalı dizilimleri düzeltti. Bu sayede Henry Moseley, günümüzdeki periyodik tablonun temelini atmıştır. Elementleri atom numaralarına (proton sayısına) göre sıralamıştır. Periyodik yasayı;
“Elementler artan atom numaralarına göre sıralandığında element özellikleri periyodik olarak tekrarlanır”
şeklinde tanımlamış ve modern periyodik cetvelin temellerini atmıştır.
Modern Periyodik Cetvel

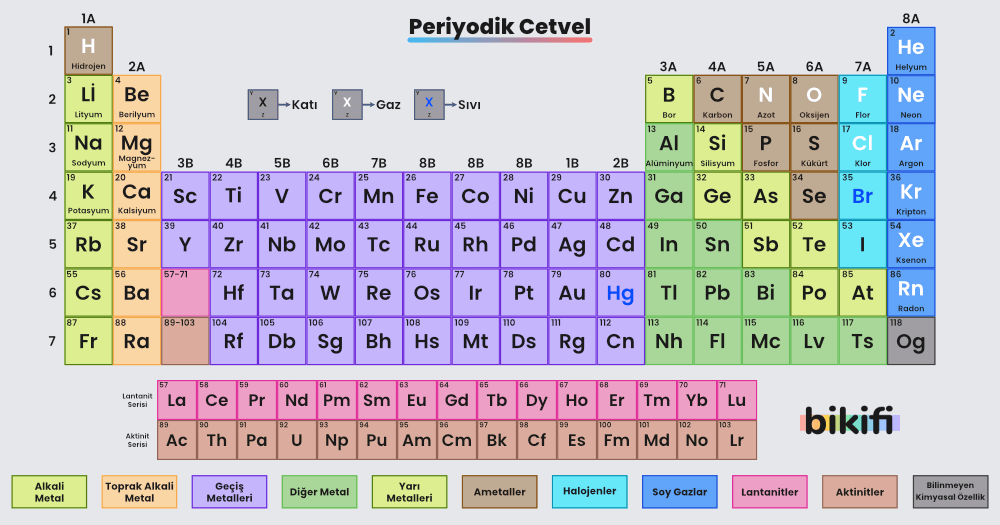
Moseleyin çalışmaları ve düzenlediği periyodik yasaya göre elementleri artan atom sırasına göre yan yana, benzer özelliklerine göre de alt alta sıralayan bir periyodik tablo oluşturulmuştur. Günümüzde kullanılan periyodik tabloyu yukarıda görebilirsiniz. Periyodik tabloyla ilgili bilgiler bulabileceğiniz etkileşimli periyodik cetvel => https://www.ptable.com/?lang=tr.
Periyodik tablodaki yatay satırlara periyot, dikey sütunlara ise grup denir.
Periyot
Periyotlarda elementler artan atom numaralarına göre sıralanır. Periyodik cetvelde 7 tane periyot bulunur. Periyotlarda sağdan sola doğru ilerledikçe elementlerin özellikleri değişir, bu değişime periyodik değişim denir. Altıncı periyot 32 elemente sahip uzun bir periyottur, bu periyodun 14 elementi aşağıya taşınmıştır. Taşınan bu elementlere, ilk element lantan ile başladığı için lantanit serisi denir. Aynı şey yedinci periyot için de geçerlidir. Yedinci periyottan ayrılan bölümlere ise (ilk elementi aktinyum olduğu için) aktinit serisi denir.
Bir elementin periyot sayısı, o elementin sahip olduğu elektronların bulunduğu en yüksek enerji katmanını verir.
Grup
Dış katman elektron dizilimi aynı olan elementlerin oluşturduğu birliğe grup denir. Gruplar periyodik tablodaki sütunlardır. Aynı gruptaki elementlerin kimyasal özellikleri aynıdır. Gruplar iki şekilde adlandırılır. Birincisi IUPAC’ın önerdiği 1’den 18’e kadar olan sayılardır. İkincisi ise daha sık kullanılan harf (A,B) ve rakamlardan oluşan adlandırmadır. Yukarıdaki periyodik tabloda iki isimlendirmeyi de görebilirsiniz. Periyodik tabloda çok sık kullandığımız 4 önemli grup; (1A) alkali metaller, (2A) toprak alkali metaller, (7A) halojenler, (8A) Soy gazlar.
Alkali Metaller (1A)
1 A grubunda bulunan hidrojen dışındaki elementlerden oluşan grubun adıdır. Li, Na, K, Rb, Cs ve Fr elementlerinden oluşmaktadır. Değerlik katmanlarındaki elektronları kolayca vererek bileşiklerde +1 yüklü iyonlar oluştururlar; bu nedenle kuvvetli indirgendirler.
- Birkaç istisna dışında bileşikleri iyoniktir.
- Metalik özellikleri gereği parlaktırlar; fakat diğer metallerin aksine, bıçakla kesilebilecek kadar yumuşaklardır.
- Aleve tutulduklarında çeşitli renkler oluştururlar.
- Isı ve elektriği çok iyi iletirler.
- Bulundukları periyotta iyonlaşma enerjileri en küçük, atom ve iyon çapları ise en büyük olan elementlerdir.
- Diğer metallerin aksine, yoğunlukları ve erime noktaları oldukça düşüktür. Lityum, sodyum ve potasyum yoğunlukları ilginç bir şekilde sudan daha küçüktür. Sezyumun erime noktası o kadar düşüktür ki, sıcak günlerde sıvı halde bulunabilir.
- Alkali metaller su ile reaksiyona girip, hidrojen gazı verirler. Alkali metallerin su ile etkileşimi oldukça şiddetlidir. Reaksiyonun şiddeti yukarıdan aşağı inildikçe artar.
Toprak Alkali Metaller (2A)
Periyodik cetvelin 2A grubundaki bütün elementler toprak alkali metallerdir. Değerlik katmanındaki elektronları kolayca vererek bileşiklerde +2 yüklü iyonlar oluştururlar.
- Sıklıkla beyaz renkli olup, yumuşak ve işlenebilir yapıdadırlar.
- Alkali metallerden daha az tepkimelere girmeye eğilimlidirler.
- Erime ve kaynama noktaları alkali metallere göre daha düşüktür.
- İyonlaşma enerjileri de alkali metallerden daha yüksektir.
- Toprak elementleri ismi, bu gruptaki elementlerin toprakta bulunan oksitlerinin, eski kimya bilimciler tarafından ayrı birer element olarak düşünülmesinden gelir.
Halojenler (7A)
Halojenler, periyodik tablonun 7A grubunda bulunan “flor, klor, brom ve iyot” elementlerinden oluşan ametallerin özel bir sınıfıdır.
- Bu gruptaki elementlerin hepsinin elektronegatifliği yüksektir. Diğer bir deyişle elektron alma eğilimi en yüksek olan elementlerdir.
- Tepkimeye girmeye eğilimindedirler (özellikle alkali metal ve toprak alkali metalleri ile).
- Oda koşullarında flor ve klor gaz, brom sıvı, iyotsa katı haldedir. Erime ve kaynama noktaları grupta aşağıdan yukarıya doğru azalır.
- Halojenler metallerle reaksiyona girerek iyonik tuzları oluştururlar.
- Zehirli ve tehlikeli elementler olarak bilinirler.
- Doğada elementel olarak değil, mineraller halinde bulunurlar.
Soy Gazlar (8A)
8A grubunda bulunan He, Ne, Ar, Kr, Xe ve Rn elementlerinin oluşturduğu gruba soy gazlar denir.
- Soy gazlar reaksiyon verme eğiliminde olmayan ametallerdir. Soy gazların tepkimeye girme istekleri şöyle sıralanabilir. Ne > He > Ar > Kr > Xe > Rn .
- Bu elementlerin atomlarının son katmanlarındaki kabuklar tamamen doludur ve helyum hariç (helyumun 2) son katmanlarında 8 elektron bulunur.
- Bütün asal gazlar havanın içerisinde bulunur (hatta havanın %1’i argondan oluşmaktadır).
- Doğada element halinde bulunur.
- Normal koşullarda gaz halinde bulunur.
- Metallerle, ametallerle ve birbirleriyle bileşik oluşturmaz.
- Kararlı bir yapıya sahiptir.
Diğer moleküller bileşiklerde dış katmanlarındaki elektron sayısını soy gazlara benzetmeye çalışırlar. Bunun sonucu olarak oktet ve dublet kuralları çıkmıştır.
Oktet Kuralı: Oktet kuralı atomların son katmanındaki elektron dizilimini soy gazlara benzetmeye çalışır. Yani son katmandaki elektron sayısını 8e tamamlar. Örnek: CO2 molekülü oktet kuralına uyar.
Dublet Kuralı: Son katmanın, helyuma benzemek isteyen elementlerde gözlemlenen kuraldır. Yani elektron sayısını ikiye tamamlamak için kullanılır. Örnek olarak lityumun oluşturduğu bileşikler verilebilir.
Periyodik Tabloda Sınıflandırma
Periyodik tabloda elementler, ametaller, metaller, yarı metaller ve soy gazlar olmak üzere 4 sınıfta incelenir.

Metal
Metaller (hidrojen hariç) 1A, 2A, 3A ve B gruplarının hepsinde bulunan elementlerden oluşmaktadır. Yukarıdaki periyodik cetvelde açık mavi rengiyle belirtilmiştir.
- En dış katmanlarındaki (değerlik elektron) sayısı azdır. Bu yüzden oktet/dublet kuralını elektron vererek uygular.
- Oda koşullarında (yaklaşık 25 derecede) civa hariç hepsi katı halde bulunur.
- Ametallerle birleşik oluştururlar, bileşiklerde elektron vererek katyon (+ yüklü) iyonunu oluştururlar.
- Isıyı iyi iletirler.
- Katı ve sıvısı elektriği iletir.
- Parlaktır.
- Kolayca işlenerek tel ve levha haline getirilebilirler.
- Erime ve kaynama sıcaklıkları yüksektir.
Ametal
Genellikle metallerin tam tersi özelliklere sahip olan ametaller, periyodik cetvelin 4A, 5A, 6A ve 7A gruplarının elementlerinden oluşmaktadır. Yukarıdaki periyodik cetvelde turuncu renkle belirtilmiştir.
- En dış katmanlarındaki (değerlik elektron) sayısı fazladır. Genellikle bileşiklerde elektron almaya yatkındır.
- Kendi elementleriyle bileşik oluşturabilir. Böyle bir ilişkide elektronların ortaklaşa kullanımı söz konusudur.
- Oda koşullarında (yaklaşık 25 derece) katı, sıvı veya gaz halinde bulunabilir.
- Metallerle ve ametallerle bileşik oluştururlar.
- Normal şartlarda grafit hariç elektriği ve ısıyı iletmezler.
- Mattır.
- Kolayca işlenemez çünkü kırılgandır.
- Erime ve kaynama sıcaklıkları düşüktür.
Yarı Metal
Metallerle ametaller arasında bulunan yarı metaller; bor, silisyum, germanyum, arsenik, antimon ve tellür elementlerinden oluşmaktadır. Periyodik cetvelde zig-zag şeklinde gözükmektedir (mor ile renklendirilmiştir). Yarı metaller görünüş olarak metallere, kimyasal özellik bakımından ametallere benzemektedir. Bu yüzden ametallerin bir alt sınıfı sayılır.
- Metallerle alaşım oluşturabilirler.
- Ametallerle bileşik oluşturabilirler.
- Oda koşullarında katı halde bulunur.
- Genellikle parlaktır.
- Elektriği ametallere göre daha iyi iletirler. Metallere göre da az iletirler.
- İşlenebilirler.
- Isıyı iletirler (metallerden az).
- Erime ve kaynama sıcaklıkları düşüktür.
Soygaz
Periyodik tablonun 8A elementlerinden oluşmaktadır. Genellikle periyodik cetvelde ametal gibi gösterilir ancak ametallerin özel bir grubudur.
- En dış katmanında 8 elektron bulunur (Helyum elementinde 2 elektron vardır).
- Kimyasal tepkimeye girmez. Kararlı bir yapıdadır.
- Laboratuvar şartlarında ametallerle bileşik oluşturabilirler.
- Oda koşullarında tek atomlu gaz halde bulunur.
- Elektriği ve ısıyı iletmezler.
Devam Konu Anlatımı: Periyodik Sistem – Periyodik Özellikler













