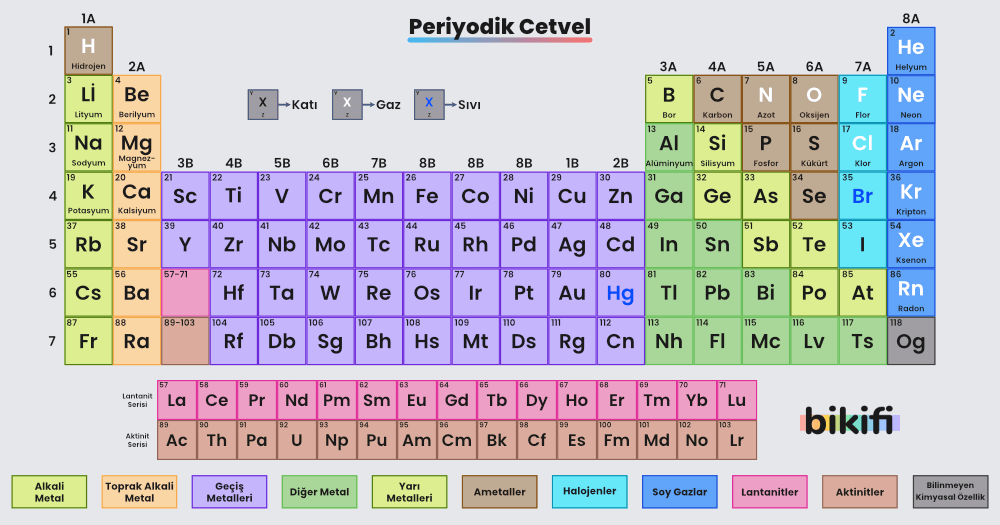
Periyodik cetvelin bilim insanlarına sağladığı en büyük fayda, bir elementin sadece periyodik cetvedeki yerini bilerek onun hakkında bazı bilgilere anında ulaşabilmektir. Periyodik cetvelin yapısı gereği bir takım özellikler periyodik olarak artar veya azalır. Bu özelliklere periyodik özellikler denir. Periyodik özellikler; atom yarı çapı, iyonlaşma enerjisi, elektron ilgisi, elektronegativite ve metalik-ametalik özellik olarak sıralanabilir. Periyodik özelliklerin hemen hemen hepsi elektronların orbitallere dizilişine bağlı olarak açıklanabilir (ya da daha basit bir yorumla, atomun yarıçap büyüklüğüne bağlıdır).
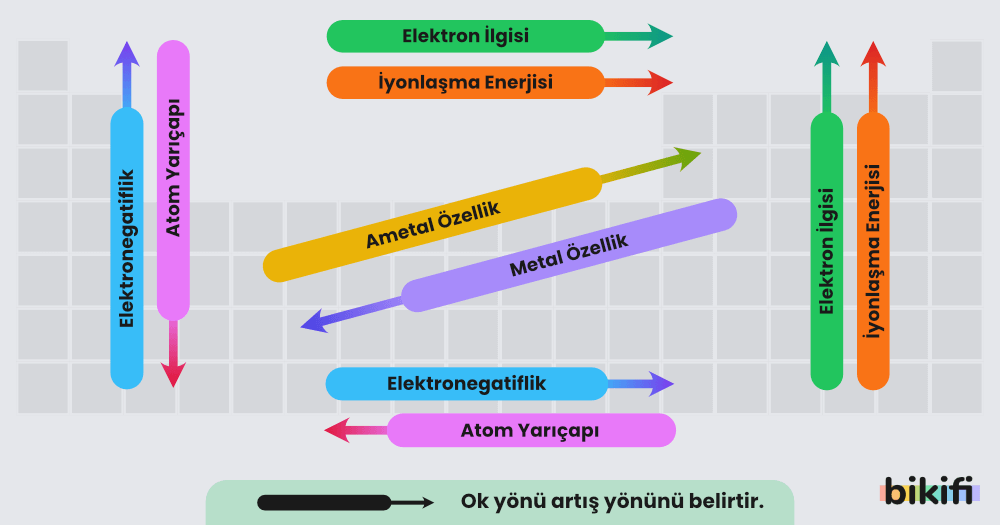
Periyodik Özellikler
Atom Yarı Çapı
Elementlerin çoğu fiziksel özellikleri (erime, kaynama vs) atomun hacmine bağlıdır. Ancak atomların kesin hacmini ölçmek, elektronların kesin olmayan dağılımları yüzünden, zordur. Bu yüzden daha kesin sonuçlar alabilmek için atomların yarı çapları “birbirine kimyasal bağlarla bağlı aynı cins iki atomun çekirdekleri arasındaki uzaklığın yarısıdır” şeklinde tanımlanır. Aşağıdaki görseldeki gibi ölçülür.

Periyodik cetvelde atom yarıçapı şu şekilde değişir:
- Aynı periyotta soldan sağa doğru atom yarıçapı ve hacmi azalır.
- Aynı grupta yukarıdan aşağıya doğru atom yarıçapı ve hacmi büyür.
- Genellikle temel enerji düzeyi sayısı (n, katman sayısı) büyük olan element atomlarının çapı büyüktür. Örneğin 4Be ile 12Mg elementlerinde magnezyumun atom yarıçapı daha büyüktür.
- Temel enerji düzeyi sayısı eşitse atom numarası büyük olan element atomlarının çapı küçüktür.
- Bir atom elektron aldıkça çapı büyür. Elektron verdikçe çapı küçülür. Dolayısıyla aynı atomlar için elektronu fazla olan iyonun çapı büyüktür.
İyonlaşma Enerjisi
Gaz halinde nötral bir atomdan bir elektron uzaklaştırmak için verilmesi gereken enerjiye iyonlaşma enerjisi denir. İyonlaşma enerjisi bir atomun elektronlarından birini koparıp sonsuz uzaklığa götürmek ve bir fazla artı yüklü yeni bir atom iyonu oluşturmak için gerekli enerji olarak da tanımlanabilir. Genel tepkimesi şu şekildedir;
Gaz halindeki nötr bir atomdan bir elektron uzaklaştırmak için gerekli enerji, birinci iyonlaşma enerjisidir ve (İE1) şeklinde gösterilir. “+1 yüklü” iyondan ikinci elektronu uzaklaştırmak için gerekli enerji, ikinci iyonlaşma enerjisidir ve (İE2) şeklinde gösterilir. İyonlaşma olayında önce enerjisi en yüksek yani çekirdekten en uzak olan elektron koparılır.
! NOT: Bir elektronu uzaklaştırmak için verilecek enerji, elektronun çekirdekten olan uzaklığına bağlıdır (ters orantı vardır). Bu nedenle aynı grupta yukarıdan aşağıya doğru inildikçe atom yarıçapı arttığı için iyonlaşma enerjisi azalacaktır.
| Birinci | İkinci | Üçüncü | Dördüncü | Beşinci | Altıncı | Yedinci | Sekizinci | |
| H | 1312 | |||||||
| He | 2371 | 5247 | ||||||
| Li | 520 | 7297 | 11810 | |||||
| Be | 900 | 1757 | 14840 | 21000 | ||||
| B | 800 | 2430 | 3659 | 25020 | 32810 | |||
| C | 1086 | 2352 | 4619 | 6221 | 37800 | 47300 | ||
| N | 1402 | 2857 | 4577 | 7473 | 9443 | 53250 | 64340 | |
| O | 1314 | 3391 | 5301 | 7468 | 10980 | 13320 | 71300 | 84050 |
| F | 1681 | 3375 | 6045 | 8418 | 11020 | 15160 | 17860 | 92000 |
| Ne | 2080 | 3963 | 6276 | 9376 | 12190 | 15230 | — | — |
| Na | 495,8 | 4565 | 6912 | 9540 | 13360 | 16610 | 20110 | 25490 |
| Mg | 737,6 | 1450 | 7732 | 10550 | 13620 | 18000 | 21700 | 25660 |
| Al | 577,4 | 1816 | 2744 | 11580 | 15030 | 18370 | 23290 | 27460 |
| Si | 786,2 | 1577 | 3229 | 4356 | 16080 | 19790 | 23780 | 29250 |
| P | 1012 | 1896 | 2910 | 4954 | 6272 | 21270 | 25410 | 29840 |
| S | 999,6 | 2260 | 3380 | 4565 | 6996 | 8490 | 28080 | 31720 |
| Cl | 1255 | 2297 | 3850 | 5146 | 6544 | 9330 | 11020 | 33600 |
| Ar | 1520 | 2665 | 3947 | 5770 | 7240 | 8810 | 11970 | 13840 |
| K | 418,8 | 3069 | 4600 | 5879 | 7971 | 9619 | 11380 | 14950 |
| Ca | 589,5 | 1146 | 4941 | 6485 | 8142 | 10520 | 12350 | 13830 |
Yukarıdaki tabloda ilk 20 elementin iyonlaşma enerjilerini görebilirsiniz. İyonlaşma enerjisinin hızlıca arttığı (sıçrama yaptığı) değerler ilgili atomun “değerlik” sayısıdır. Bu sayede atomun periyodik cetvelde “A grubundaki” yerini bilmemizi sağlar.
Periyot Boyunca İyonlaşma Enerjisi Değişimi
İyonlaşma enerjisinin periyot boyunca değişimi düzensizdir. Çünkü soldan sağa doğru gidildikçe atom yarıçapları küçülür, çekirdek yükleri artar; bu durumda iyonlaşma enerjisinin artmasına neden olur. Ancak bazı gruplarda oluşan orbital dizilimlerinden kaynaklı, iyonlaşma enerjisindeki artış düzenli olmaz ve aynı grup içindeki sıralama şu şekilde olur;
1A < 3A < 2A < 4A < 6A < 5A < 7A < 8A
Elektron İlgisi
Gaz halinde nötral bir atomun bir elektron yakalaması sırasında açığa çıkan enerjiye elektron ilgisi denir. Elektron ilgisi, atom yarıçapı ya da iyonlaşma enerjisine göre daha az periyodik olmasına rağmen atom yarıçapındaki değişim ile paralellik gösterir. Atom yarıçapı küçüldükçe elektron ilgisi artar.
F + e F + Enerji
Florun elektron ilgisinin değer +328 kj/mol olarak gösterilir. Bir elementin elektron ilgisi değeri çok pozitif ise o elementin elektron kabul etme eğilimi büyüktür.
- Aynı periyotta soldan sağa doğru gidildikçe elementin elektron ilgisi artar.
- Metallerin ve soygazların elektron ilgisi yoktur, sadece ametallerde elektron ilgisi gözlemlenir.
- Aynı gurupta yukarıdan aşağıya inildikçe elementlerin elektron ilgisi azalır.
Elektronegativite
Bir atomun kimyasal bağda bağ yapan elektronları kendisine çekme gücüne elektronegatiflik veya elektronegativite denir. Elementlerin elektronegatifliklerini sıralayabilmek için florun elektronegatifliği 4.0 olarak kabul edilmiştir.

- Periyodik tabloda soldan sağa doğru gidildikçe atom çapı küçülür, elektronegatiflik artar.
- Aynı grupta yukarıdan aşağı doğru gidildikçe atom çapı artar, çekirdeğin çekim gücü azalır, elektronegatiflik azalır.
Metal – Ametal Özellik
Metallerin değerlik elektron sayısı genellikle az ve dolayısıyla iyonlaşma enerjileri düşüktür. Bu sebeple hidrojen hariç 1A grubu elementleri, 2A grubu elementleri, tüm B grubu elementleri, bor hariç tüm 3A grubu metaldir. Periyodik tabloda sağdan sola doğru gidildikçe, metalik özellik özellik azalır. Ancak metalik özellikler birden bitip ametallik özellik başlamaz. Metallerden ametallere geçiş süreci “yarı metaller” ile başlar.
- Metalik özellik periyodik cetvelde (aynı grup içerisinde) sağdan sola ve (aynı periyot içerisinde) yukarıdan aşağıya gittikçe artar.
- Ametalik özellik periyodik cetvelde (aynı grup içerisinde) sağdan sola ve (aynı periyot içerisinde) yukarıdan aşağıya gittikçe azalır.













