Periyodik cetvelin bilim insanlarına sağladığı en büyük fayda, bir elementin sadece periyodik cetvedeki yerini bilerek onun hakkında bazı bilgilere anında ulaşabilmektir. Periyodik cetvelin yapısı gereği bir takım özellikler periyodik olarak artar veya azalır. Bu özelliklere periyodik özellikler denir. Bu ders notunda, atom yarıçapı, iyon yarıçapı, iyonlaşma enerjisi ve elektronegatiflik kavramlarını inceleyeceğiz.
Atom Yarıçapı
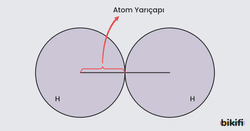
Atom yarıçapı, basitçe bir atomun büyüklüğünü ifade eden bir kavramdır. Elementlerin çoğu fiziksel özellikleri (erime, kaynama vb) atomun hacmine bağlıdır. Ancak atomların kesin hacmini ölçmek, elektronların kesin olmayan dağılımları yüzünden, zordur. Atomun çekirdeği ile en dıştaki elektron katmanı arasındaki ortalama mesafe olarak düşünülebilir. Bu tanım, atomlar arasındaki etkileşimleri anlamak açısından oldukça önemlidir.
Atom yarıçapının büyüklüğü, o atomun elektronlarının ne kadar gevşek veya sıkı tutulduğunu, dolayısıyla kimyasal bağ yapma eğilimini etkiler. Örneğin, kolayca elektron kaybedebilen büyük atomlar ile elektronları daha sıkı tutan küçük atomlar arasında farklı kimyasal davranışlar gözlenir.
Mutfakta kullandığımız tuzun (NaCl) oluşumunda, sodyum (Na) atomunun nispeten büyük olması elektron vermesini kolaylaştırır. Klor (Cl) ise daha küçük bir yarıçapa sahiptir ve elektronu almaya yatkındır.
Periyodik Tabloda Atom Yarıçapının Değişim Eğilimleri
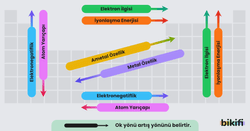
- Periyotta (yatay satır) sağdan sola gidildikçe atom yarıçapı genellikle büyür. Bunun temel nedeni, proton sayısının artmasıyla çekirdeğin elektronları daha güçlü çekmesidir.
- Grupta (dikey sütun) yukarıdan aşağıya inildikçe atom yarıçapı genellikle büyür. Çünkü daha fazla katman (enerji seviyesi) devreye girer ve elektronlar çekirdekten daha uzakta bulunur.
Örneğin, 1. periyotta yer alan elementler çok az katmana sahip oldukları için daha küçük yarıçapa sahiptir. 3. periyottaki elementler ise daha fazla katmana sahip olduğu için genelde daha büyük yarıçapa sahiptir.
İyon Yarıçapı
İyon yarıçapı, nötr atomdan elektron alarak (anyon) ya da vererek (katyon) oluşan iyonların büyüklüğünü ifade eder.
- Katyonlar (elektron kaybetmiş iyonlar) genelde nötr atomlarından daha küçük olur. Çünkü elektron sayısının azalması, çekirdeğin kalan elektronları daha güçlü çekmesine yol açar.
- Anyonlar (elektron kazanmış iyonlar) genelde nötr atomlarından daha büyük olur. Fazladan elektron, elektron-elektron itmesini artırır ve ortalama yarıçap genişler.
İyonlaşma Enerjisi
İyonlaşma enerjisi, gaz hâlindeki bir atomdan bir elektron koparmak için gereken enerjidir. Başka bir ifadeyle iyonlaşma enerjisi bir atomun elektronlarından birini koparıp sonsuz uzaklığa götürmek ve bir fazla artı yüklü yeni bir atom iyonu oluşturmak için gerekli enerji olarak da tanımlanabilir. Genel tepkimesi şu şekildedir;
Gaz halindeki nötr bir atomdan bir elektron uzaklaştırmak için gerekli enerji, birinci iyonlaşma enerjisidir ve (İE1) şeklinde gösterilir. “+1 yüklü” iyondan ikinci elektronu uzaklaştırmak için gerekli enerji, ikinci iyonlaşma enerjisidir ve (İE2) şeklinde gösterilir. İyonlaşma olayında önce enerjisi en yüksek yani çekirdekten en uzak olan elektron koparılır.
Periyodik Tabloda İyonlaşma Enerjisinin Değişim Eğilimleri
- Periyotta soldan sağa gidildikçe iyonlaşma enerjisi genellikleartar. Çünkü çekirdek yükü arttıkça elektronlar daha sıkı tutulur ve koparmak için daha fazla enerji gerekir.
- Grupta yukarıdan aşağıya inildikçe iyonlaşma enerjisi genellikleazalır. Katman sayısı arttıkça elektronlar çekirdekten daha uzakta olur ve koparmak daha kolay hale gelir.
Bu yüzden, en yüksek iyonlaşma enerjisi genellikle periyodik tablonun sağ üst tarafındaki elementlerde, en düşük iyonlaşma enerjisi ise sol alt kısımdaki elementlerde gözlenir.
Uyarı: İyonlaşma enerjisinin periyot boyunca değişimi düzensizdir. Çünkü soldan sağa doğru gidildikçe atom yarıçapları küçülür, çekirdek yükleri artar; bu durumda iyonlaşma enerjisinin artmasına neden olur. Ancak bazı gruplarda oluşan orbital dizilimlerinden kaynaklı, iyonlaşma enerjisindeki artış düzenli olmaz ve aynı grup içindeki sıralama şu şekilde olur;
1A < 3A < 2A < 4A < 6A < 5A < 7A < 8A
| Birinci (İE1) | İkinci (İE2) | Üçüncü (İE3) | Dördüncü (İE4) | Beşinci (İE5) | Altıncı (İE6) | Yedinci (İE7) | Sekizinci (İE8) | |
| H | 1312 | |||||||
| He | 2371 | 5247 | ||||||
| Li | 520 | 7297 | 11810 | |||||
| Be | 900 | 1757 | 14840 | 21000 | ||||
| B | 800 | 2430 | 3659 | 25020 | 32810 | |||
| C | 1086 | 2352 | 4619 | 6221 | 37800 | 47300 | ||
| N | 1402 | 2857 | 4577 | 7473 | 9443 | 53250 | 64340 | |
| O | 1314 | 3391 | 5301 | 7468 | 10980 | 13320 | 71300 | 84050 |
| F | 1681 | 3375 | 6045 | 8418 | 11020 | 15160 | 17860 | 92000 |
| Ne | 2080 | 3963 | 6276 | 9376 | 12190 | 15230 | — | — |
| Na | 495,8 | 4565 | 6912 | 9540 | 13360 | 16610 | 20110 | 25490 |
| Mg | 737,6 | 1450 | 7732 | 10550 | 13620 | 18000 | 21700 | 25660 |
| Al | 577,4 | 1816 | 2744 | 11580 | 15030 | 18370 | 23290 | 27460 |
| Si | 786,2 | 1577 | 3229 | 4356 | 16080 | 19790 | 23780 | 29250 |
| P | 1012 | 1896 | 2910 | 4954 | 6272 | 21270 | 25410 | 29840 |
| S | 999,6 | 2260 | 3380 | 4565 | 6996 | 8490 | 28080 | 31720 |
| Cl | 1255 | 2297 | 3850 | 5146 | 6544 | 9330 | 11020 | 33600 |
| Ar | 1520 | 2665 | 3947 | 5770 | 7240 | 8810 | 11970 | 13840 |
| K | 418,8 | 3069 | 4600 | 5879 | 7971 | 9619 | 11380 | 14950 |
| Ca | 589,5 | 1146 | 4941 | 6485 | 8142 | 10520 | 12350 | 13830 |
Yukarıdaki tabloda ilk 20 elementin iyonlaşma enerjilerini görebilirsiniz. İyonlaşma enerjisinin hızlıca arttığı (sıçrama yaparak ani yükseldiği) değerler ilgili atomun “değerlik” sayısıdır. Bu sayede atomun periyodik cetvelde “A grubundaki” yerini bilmemizi sağlar.
Elektronegatiflik
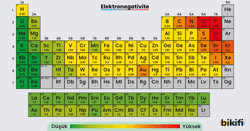
Elektronegatiflik, bir atomun bağ yaptığı elektronları kendisine doğru çekme yeteneğini ifade eder. Yani, ortaklaşa kullanılan elektronlar hangi atoma daha yakın duracak sorusunun yanıtı elektronegatiflikle ilgilidir.
Periyodik Tabloda Elektronegatiflik Değerinin Değişim Eğilimleri
- Periyotta soldan sağa gidildikçe elektronegatiflik genellikle artar. Çünkü çekirdeğin çekim gücü artar ve elektronları kendine daha çok çeker.
- Grupta yukarıdan aşağıya inildikçe elektronegatiflik genellikle azalır. Katman sayısının artması ve elektronların çekirdekten uzaklaşması nedeniyle çekim gücü zayıflar.
Metal atomlarının elektronegatiflik değerleri düşük, ametal atomlarının elektronegatiflik değerleri yüksektir. Örneğin flor (F) periyodik tablonun en elektronegatif elementlerinden biridir.
Elektronegatiflik, bağ ve molekül polarlığının belirlenmesinde kullanılan oldukça önemli bir kavramdır. Elektronegatifliğin periyodik tablodaki değişiminin bilinmesi bağ ve molekül polarlığının tahmin edilebilmesini sağlar. Günlük hayatta su () molekülünün polar olması, oksijen atomunun hidrojene göre daha elektronegatif olmasından kaynaklanır. Bu da suyun birçok çözücü özelliğe sahip olmasını açıklar.
Periyodik Özellikler Konusu İçin İpuçları
- Periyodik tabloyu ezberlemek yerine genel eğilimleri öğrenmeye çalışın.
- Bir özellik (örneğin atom yarıçapı) incelenirken, proton sayısının ve elektron katmanlarının değişimini düşünün.
- Sorularda “En büyük yarıçap hangisidir?”, “En yüksek iyonlaşma enerjisi kimde görülür?” gibi karşılaştırma istekleri varsa, periyodik eğilimleri rehber olarak kullanın.
- İstisnalar (d-blok elementleri veya yarı dolu orbital kararlılıkları gibi) olabilir. Ancak genel kural ve eğilimlerin, büyük çoğunlukla geçerli olduğunu unutmayın.
- Günlük hayattan örneklerle ilişkilendirmeye çalışın. Metallerin parlak, işlenebilir ve genelde elektron vermeye meyilli olması ile ametallerin elektron alma eğilimleri gibi basit karşılaştırmalar, konuyu akılda kalıcı hale getirir.
Periyodik Özellikler Özeti
- Atom yarıçapı: Çekirdekten dış katmana kadar olan ortalama mesafe. Periyotta soldan sağa azalır, grupta yukarıdan aşağı büyür.
- İyon yarıçapı: Katyonlar nötr atomdan daha küçük, anyonlar ise daha büyüktür.
- İyonlaşma enerjisi: Bir atomdan elektron koparmak için gereken enerji. Periyotta soldan sağa artar, grupta yukarıdan aşağı azalır.
- Elektronegatiflik: Bağ elektronlarını çekme gücü. Periyotta soldan sağa artar, grupta yukarıdan aşağı azalır.