Çevrenizde hiç parfüm kokusu nasıl yayılıyor diye düşündünüz mü? Ya da balonunuzun neden zamanla sönüyor? İşte bu soruların cevabı, gazların nasıl hareket ettiğini açıklayan Graham Difüzyon ve Efüzyon Yasası’nda gizli. Bu derste, gaz moleküllerinin görünmez hareketlerini ve bunların günlük hayatımızdaki etkilerini keşfedeceğiz.
Giriş: Gazların Hareketi
Gazlar, gözle görülmese de sürekli hareket halindedir. Bu hareket hem makroskopik (büyük ölçekte) hem de mikroskopik (molekül düzeyinde) olarak gerçekleşir.
Makroskopik ve Mikroskopik Hareket
Makroskopik hareket, gözle görebildiğimiz büyük ölçekli hareketlerdir. Rüzgarın esmesi, balonun havayla dolması gibi. Mikroskopik hareket ise molekül düzeyinde gerçekleşen, gözle göremediğimiz hareketlerdir.
Pencereden gelen güneş ışığında süzülen toz taneciklerini düşünün. Bu taneciklerin dans ediyormuş gibi hareket ettiğini görürsünüz. İşte bu, havadaki gaz moleküllerinin toz taneciklerine çarpması sonucu oluşur. Benzer şekilde, bir bardak suya mürekkep damlatıldığında, mürekkebin yavaş yavaş yayılması da moleküler hareketin bir sonucudur.
Gaz Moleküllerinin Hareketi
Gaz molekülleri sürekli titreşim (aynı nokta etrafında salınım) ve yer değiştirme hareketi yaparlar. Bu hareketler rastgeledir ve her yöne doğru gerçekleşir.
Parfüm şişesini açtığınızda, kokuyu odanın her köşesinde hissedersiniz. Bu durum, parfüm moleküllerinin havada hareket etmesi sonucudur. İlginç olan nokta, odada hiç hava akımı olmasa bile bu yayılmanın gerçekleşmesidir. Hayvanların feromonlarla (kimyasal sinyal molekülleri) kilometrelerce uzaktan iletişim kurması da aynı prensiple çalışır.
Önemli Not: Gaz moleküllerinin hareketi, hava akımından bağımsız olarak gerçekleşir. Hava akımı bu hareketi hızlandırır ancak hareketin nedeni değildir.
Graham Difüzyon ve Efüzyon Yasası
1829 yılında İskoç kimyager Thomas Graham, gazların hareketini incelerken önemli bir keşif yaptı: Gazların hareket hızı, molekül ağırlıklarına bağlıdır. Bu keşif, Graham Yasası olarak bilinir.
Gazların Yolculuğu
Graham’ın Deney Düzeneği
Graham, deneyinde gözenekli bir tıpa kullanarak gazların hareketini inceledi. Deney düzeneğinde bir tarafta test edilecek gaz, diğer tarafta su bulunur.
Hidrojen gazı ile normal hava karşılaştırıldığında ilginç bir sonuç ortaya çıkar:
- Hidrojen gazı daha hafif olduğu için (2 g/mol) daha hızlı hareket eder
- Normal hava daha ağır olduğu için (ortalama 29 g/mol) daha yavaş hareket eder
- Su seviyesi, hangi gazın daha hızlı hareket ettiğine göre yükselir veya alçalır
Vakumlu Deney Düzeneği
Modern deneylerde, daha hassas ölçümler için vakumlu sistemler kullanılır. Bu düzenekte:
- Filtre şişesi içine test gazı konur
- Şişenin ağzında 0,015 cm çapında küçük bir delik bulunur
- Şırınga ile gaz çekilir ve kronometre ile süre ölçülür
İpucu: Delik ne kadar küçükse, ölçüm o kadar hassas olur.
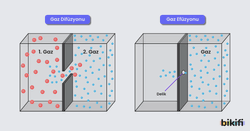
Difüzyon Kavramı
Difüzyon, gaz moleküllerinin yüksek konsantrasyondan (yoğunluktan) düşük konsantrasyona doğru kendiliğinden yayılmasıdır. Bu süreç, konsantrasyon farkı ortadan kalkana kadar devam eder.
Mutfakta yemek pişirirken kokuyu evin her köşesinde hissedersiniz. İşte bu difüzyondur! Yemek molekülleri, yoğun oldukları mutfaktan, az yoğun oldukları diğer odalara doğru yayılır.
Difüzyon sürecinde moleküller:
- Birbirleriyle sürekli çarpışır
- Rastgele yönlerde hareket eder
- Zamanla homojen (eşit) dağılım oluştururlar
Efüzyon Kavramı
Efüzyon, gaz moleküllerinin küçük bir delikten vakuma veya düşük basınçlı ortama kaçmasıdır. Bu süreç için basınç farkı gereklidir.
Araba lastiğindeki küçük bir delikten havanın kaçması efüzyona örnektir. Lastiğin içindeki basınç dışarıdan yüksek olduğu için, hava molekülleri delikten dışarı kaçar.
Efüzyonu anlamak için pilates topu ve basketbol potası örneğini düşünün: Top, potadan geçemez çünkü çok büyüktür. Ancak topu küçük parçalara ayırırsanız, her parça kolayca geçebilir. İşte moleküller de tek tek bu küçük deliklerden geçer.
Difüzyon ve Efüzyon Karşılaştırması
Bu iki kavram birbirine benzese de aralarında önemli farklar vardır.
Hız Farklılıkları
Graham Yasası’na göre, gazların difüzyon ve efüzyon hızları molekül ağırlıklarının kareköküyle ters orantılıdır:
Bu formül bize şunu söyler: Molekül ağırlığı (M) azaldıkça, hız (v) artar.
Örneğin:
- Helyum (4 g/mol) hidrojen gazından (2 g/mol) daha yavaş
- Oksijen (32 g/mol) azot gazından (28 g/mol) daha yavaş
- Karbondioksit (44 g/mol) havadan (29 g/mol) daha yavaş hareket eder
Süreç Özellikleri
Difüzyon Özellikleri
Difüzyon süreci şu özelliklere sahiptir:
- Konsantrasyon kaynaklıdır: Moleküller yoğun bölgeden seyrek bölgeye doğru hareket eder
- Bariyer yoktur: Moleküller serbestçe her yöne hareket edebilir
- Sıcaklık etkilidir: Sıcaklık arttıkça difüzyon hızı artar
- Parçacık boyutu önemlidir: Küçük moleküller daha hızlı difüze olur
Efüzyon Özellikleri
Efüzyon süreci ise farklı özelliklere sahiptir:
- Basınç farkı kaynaklıdır: Yüksek basınçtan düşük basınca doğru gerçekleşir
- Küçük delik gereklidir: Moleküllerin tek tek geçebileceği boyutta olmalı
- Delik boyutu kritiktir: Çok büyük delik efüzyonu bozar, normal gaz akışı oluşur
İzotop Ayrımı Uygulaması
Graham Yasası’nın en önemli endüstriyel uygulamalarından biri uranyum zenginleştirmedir. Nükleer santrallerde kullanılan uranyum-235 izotopu, doğal uranyumda sadece %0,7 oranında bulunur. Bu oranı artırmak için efüzyon kullanılır.
İşlem şöyle gerçekleşir:
- Uranyum, UF₆ (uranyum heksaflorür) gazına dönüştürülür
- ²³⁵UF₆ (349 g/mol) molekülleri, ²³⁸UF₆ (352 g/mol) moleküllerinden hafif olduğu için daha hızlı efüze olur
- Bu işlem binlerce kez tekrarlanır
- Sonuçta %3-5 oranında zenginleştirilmiş uranyum elde edilir
Not: Kütle farkı çok küçük olduğu için (%0,86), ayrım işlemi binlerce kez tekrarlanmalıdır.
Uygulamalar ve Günlük Hayat
Graham Yasası’nın prensipleri, günlük hayattan ileri teknolojiye kadar birçok alanda kullanılır.
Efüzyon Uygulamaları
Kütle Spektrometrisi
Kütle spektrometrisi, moleküllerin kütlesini belirlemek için kullanılan bir analiz yöntemidir. Cihazda:
- Moleküller iyonlaştırılır (elektrik yüklü hale getirilir)
- İyonlar küçük bir delikten geçirilir
- Kütle-yük oranına göre ayrılırlar
- Sonuçlar dedektörde toplanır
Bu yöntem, ilaç analizlerinden uzay araştırmalarına kadar geniş kullanım alanına sahiptir.
Vakum Teknolojisi
Vakum sistemlerinde istenmeyen gazların uzaklaştırılması için efüzyon kullanılır. Elektronik cihaz üretiminde, vakum ortamı oluşturmak kritiktir. Efüzyon pompaları, kontrollü bir şekilde gaz moleküllerini sistemden uzaklaştırır.
Yarı İletken Üretimi
Bilgisayar çiplerinin üretiminde, silikon yüzeye çok ince filmler biriktirilir. Bu işlemde:
- Kaplama malzemesi buharlaştırılır
- Moleküller efüzyon yoluyla yüzeye ulaşır
- Kontrollü biriktirme sağlanır
- Nanometre hassasiyetinde filmler oluşturulur
Difüzyon Uygulamaları
Biyolojik Sistemler
Vücudumuzda her saniye milyonlarca difüzyon olayı gerçekleşir:
- Akciğerlerde: Oksijen kana, karbondioksit akciğere difüze olur
- Hücrelerde: Besin maddeleri hücre zarından difüzyonla geçer
- Sinir sisteminde: Sinyal molekülleri sinapslar arasında difüze olur
Vücudumuzun yaşaması difüzyon sayesinde mümkündür!
İlaç Salınımı
Modern ilaçlarda kontrollü salım sistemleri kullanılır. İlaç, özel bir kaplama içinde bulunur ve vücutta belirli hızda difüze olur. Bu sayede:
- İlacın etkisi uzun sürer
- Yan etkiler azalır
- Günde bir kez kullanım yeterli olur
Endüstriyel Ayırma
Petrol rafinerilerinde ve kimya endüstrisinde gaz karışımlarının ayrılmasında difüzyon kullanılır:
- Doğal gazdan helyum ayrımı
- Hava ayrımı (oksijen, azot, argon)
- Petrol buharlarının fraksiyonlanması
📚 Konuyla İlgili Terimler Özeti
- Difüzyon (⭐⭐⭐): Gaz moleküllerinin yüksek konsantrasyondan düşük konsantrasyona doğru kendiliğinden yayılması. Parfümün odaya yayılması, mürekkebin suda dağılması gibi günlük olayların temelinde difüzyon vardır.
- Efüzyon (⭐⭐⭐): Gaz moleküllerinin küçük bir delikten vakuma veya düşük basınçlı ortama kaçması. Balonun zamanla sönmesi, lastiğin hava kaybetmesi efüzyon örnekleridir.
- Graham Yasası (⭐⭐): Gazların difüzyon ve efüzyon hızlarının, molekül ağırlıklarının kareköküyle ters orantılı olduğunu belirten yasa. Formülü:
- Kinetik Moleküler Teori (⭐⭐): Gazların davranışlarını moleküllerin sürekli ve rastgele hareketleriyle açıklayan teori. Sıcaklık arttıkça molekül hızının artması bu teoriyle açıklanır.
- Konsantrasyon Gradiyenti (⭐⭐): İki bölge arasındaki yoğunluk farkı. Bu fark, moleküllerin hareket yönünü belirler.
- İzotop Ayrımı (⭐): Aynı elementin farklı kütleli atomlarının (izotoplarının) efüzyon yoluyla birbirinden ayrılması. Uranyum zenginleştirmede kullanılır.
- Moleküler Hız (⭐): Gaz moleküllerinin belirli bir sıcaklıktaki ortalama hareket hızı. Sıcaklık ve molekül kütlesiyle ilişkilidir.
📌 Önemli Notlar
- Difüzyon ve efüzyon arasındaki temel fark: Difüzyon her yöne doğru serbest yayılmayken, efüzyon küçük bir delikten kaçıştır.
- Graham Yasası’nın önemi: Bu yasa sayesinde molekül ağırlıkları hesaplanabilir ve gazlar birbirinden ayrılabilir.
- Günlük hayattaki önemi: Solunum, koku alma, ilaç tedavisi gibi hayati süreçler difüzyon prensibiyle çalışır.
- Endüstriyel uygulamalar: Uranyum zenginleştirme, gaz ayrımı, vakum teknolojisi gibi alanlarda kritik öneme sahiptir.
- Deney güvenliği: Graham deneyleri yapılırken, özellikle amonyak ve HCl gibi tahriş edici gazlarla çalışırken mutlaka havalandırmalı ortamda ve koruyucu ekipmanla çalışılmalıdır.